摘要:目的 确定多孔骨骼支架的最佳结构及孔隙率。方法 建立不同孔隙率、不同结构的18个多孔支架模型,通过有限元对多孔支架分别进行应力、应变模拟分析,通过选择性激光熔化(SLM)技术制备A,B,C这3种不同结构、孔隙率范围相近(65%~90%)、支架直径相同(300 μm)的多孔316L支架。通过压缩试验、微观组织分析、X射线衍射试验(XRD)对不同多孔支架进行表面微观组织分析及力学性能研究。通过有限元模拟获得适用于人体皮质骨及松质骨的不同多孔支架结构及孔隙率。结果 A类结构孔隙率为90%的多孔骨骼支架弹性模量为7.5 GPa,抗压强度为11.62 MPa,与人体松质骨相吻合;B类结构孔隙率为80%的多孔骨骼支架弹性模量为18.9 GPa,抗压强度为127.01 MPa,与皮质骨相吻合。结论 通过模拟及试验,确定了适用于不同骨骼部位的最佳结构及孔隙率,并且多孔结构有利于营养物质及血液的运输,保证了骨骼替代物的生物力学性能,有助于患者的康复。 骨组织缺损已经成为危害人类身体健康、降低人们生活质量的主要问题,骨骼替代物的研究对于骨组织缺损患者十分重要,理想的骨骼替代物应符合人体骨骼的相关力学性能,拥有良好生物相容性及孔隙率,以保证血液及营养物质的输送,加快患者的康复过程,并且骨骼代替物应与骨缺损部位形状一致,保证替代的成功率,因此,骨骼支架在骨组织缺损治疗中起着至关重要的作用,而传统加工方式存在支架加工精度不足、成形困难的问题。 随着增材制造技术的发展,3D 打印多孔支架(Porous scaffold)成为治疗骨组织缺损的新技术,其个性化制造的特点解决了传统制造方法由于骨缺损形状不同而导致成形困难的问题。通过增材制造技术制备多孔骨骼支架,能够有效控制支架的尺寸、孔径、孔隙率及结构特征,能够更好地保证血液、营养物质及代谢废物在骨骼支架间的运输,并且通过增材制造技术可以根据患者的不同情况进行精准的个性化制备,保证替代手术的成功率。多孔结构具有骨骼支架有利于血液、营养物质的运输以及代谢废物的排出,同时有利于骨细胞在支架上的附着并向内生长以及组织液的渗透,使植入物最终能够与生物体成功融合,加速患者的康复过程。适用于人体骨组织缺损骨骼支架的最佳结构以及孔隙率并没有定论。《SLM 成形不同孔隙结构骨支架的仿真与实验研究》一文详细论述了选区激光熔化成形多孔骨骼支架的制备工艺,并对不同孔隙率、不同结构的多孔骨骼支架进行了微观组织分析及力学性能研究。不同孔隙率适用不同骨骼位置
该研究的目的是确定多孔骨骼支架的最佳结构及孔隙率。 研究团队建立了不同孔隙率、不同结构的18个多孔支架模型,通过有限元对多孔支架分别进行应力、应变模拟分析,通过选择性激光熔化(SLM)技术制备A,B,C这3种不同结构、孔隙率范围相近(65%~90%)、支架直径相同(300 μm)的多孔316L支架。通过压缩试验、微观组织分析、X射线衍射试验(XRD)对不同多孔支架进行表面微观组织分析及力学性能研究。通过有限元模拟获得适用于人体皮质骨及松质骨的不同多孔支架结构及孔隙率。 
图1 单元结构详情 a 体心立方体结构A;b 面心立方体结构B;c 垂直立体结构C


图3 选择性激光熔化成形制备的316L不锈钢多孔骨骼支架实体
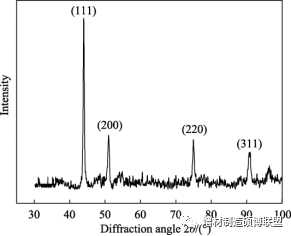

图5 微观组织
研究结果表明,A类结构孔隙率为90%的多孔骨骼支架弹性模量为7.5 GPa,抗压强度为11.62 MPa,与人体松质骨相吻合;B类结构孔隙率为80%的多孔骨骼支架弹性模量为18.9 GPa,抗压强度为127.01 MPa,与皮质骨相吻合。
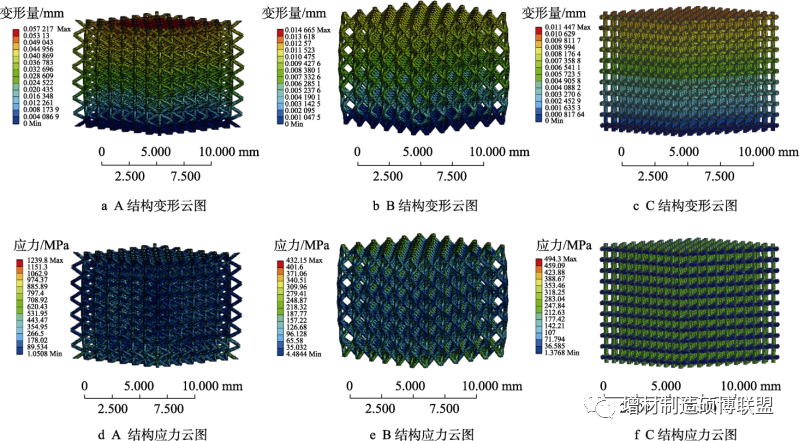

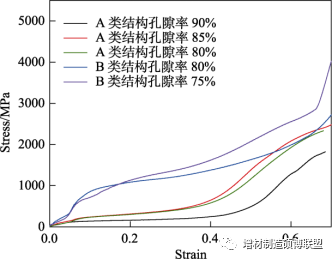
图8 应力-应变曲线
研究团队通过模拟及试验,确定了适用于不同骨骼部位的最佳结构及孔隙率,并且多孔结构有利于营养物质及血液的运输,保证了骨骼替代物的生物力学性能,有助于患者的康复。
研究结论
1)选区激光熔化成形的多孔骨骼支架组织仍为奥氏体组织,成形面上的各晶粒呈带状有规则排列且分布均匀,晶粒形态呈现多边形或近圆形,晶粒外延生长与激光熔化成形方向基本一致,采用选择性激光熔化技术制备的316L多孔骨骼支架生物力学性能符合人体骨骼植入需求,并且具有更好的力学性能。 2)通过有限元模拟分析得到了孔隙率合理的多孔骨骼支架,经优化后孔隙率为90%的多孔骨骼支架A结构的弹性模量与人体松质骨弹性模量吻合,A结构孔隙率为85%和80%、B结构孔隙率为80%和75%的多孔骨骼支架弹性模量与人体皮质骨弹性模量相符合,C结构多孔骨骼支架由于结构问题不适用于人体骨骼植入,为后续试验研究提供了理论指导。 3)通过试验探究,得到孔隙率为90%的多孔骨骼支架A结构的弹性模量与抗压强度均符合松质骨力学性能要求,适用于人体松质骨植入物,而孔隙率为80%的多孔骨骼支架B结构的弹性模量与抗压强度均符合皮质骨力学性能要求,适用于人体皮质骨植入物,明确了适用于不同骨骼位置替代的支架单元结构及孔隙率。












