医疗电磁兼容YY0505标准的【前世今生】
2005年4月5日发布医疗器械电磁兼容标准YY0505-2005;
2007年7月1日强制执行医疗器械电磁兼容标准YY0505-2005;
2012年12月17日发布医疗器械电磁兼容标准YY0505-2012替代YY0505-2005版本;
2014年1月1日强制执行医疗器械电磁兼容标准YY0505-2012;
2014年1月1日起,三类医用电气设备,在注册申报时应提交EMC检测报告;
2015年1月1日起,二类医用电气设备,在注册申报时应提交EMC检测报告;另外一类有源医用电气设备,应进行EMC检测备案报告;
2017年4月1日,正式取消医疗器械检验收费;
2018年1月22日,委托检验报告等同效力与注册检验报告;
国家食品药品监督管理局关于医疗器械的电磁兼容问题下发的文件:
YY 0505医用电气电磁兼容标准作为与GB 9706.1医用电气安全标准并列的医用电气设备通用安全标准,对于控制产品电磁兼容指标,保证人民群众用械安全起着重要的作用。按照有关标准制修订计划,国家食品药品监督管理局修订完成了YY 0505-2012《医用电气设备 第1-2部分:安全通用要求并列标准:电磁兼容 要求和试验》标准(以下简称电磁兼容标准),代替原YY 0505-2005标准。为保证标准顺利有序实施,现将相关工作要求通知如下:
一、医疗器械生产企业作为保证产品质量的第一责任人,应积极主动学习电磁兼容标准,充分理解并掌握标准要求,充分利用各种社会检测资源,从产品研制阶段开始,做好相应标准实施准备工作。在电磁兼容标准发布实施后,医疗器械生产企业应立即在研制、生产等全过程中贯彻实施电磁兼容标准,并按照《关于印发进一步加强和规范医疗器械注册管理暂行规定的通知》(国食药监械〔2008〕409号)要求组织生产,确保产品符合电磁兼容标准要求。
二、自电磁兼容标准实施之日起,首次申报注册的第Ⅲ类医用电气设备在注册申报时应提交由医疗器械检测机构出具的符合电磁兼容标准要求的检测报告。在此之前申请注册并获得受理的和已获准注册的第Ⅲ类医用电气设备,在重新注册时再提交符合电磁兼容标准要求的相应检测报告。
自电磁兼容标准实施一年后,首次申报注册的第Ⅱ类医用电气设备,在注册申报时应提交由医疗器械检测机构出具的符合电磁兼容标准要求的检测报告。首次申报注册的第I类医用电气设备提交包含电磁兼容标准要求的全性能检测报告。在此之前申请注册并获得受理和已获准注册的第I、Ⅱ类医用电气设备,在重新注册时再提交符合电磁兼容标准要求的相应检测报告。
三、医用电气设备在实施GB 9706.1标准全项检测时,应对电磁兼容性能按照电磁兼容标准要求实施检测,并对涉及电磁兼容性能的检测出具相应格式要求的检测报告。(检测报告格式另文公布)如具有GB 9706.1标准承检资格的医疗器械检测机构不具备电磁兼容标准承检资格,可根据本单位工作程序实施分包检测,具备电磁兼容标准承检能力的医疗器械检测机构应积极承接有关分包检测。分包方应对GB 9706.1和由被分包方出具的电磁兼容标准检测报告负责,并按本单位工作程序审核后出具相应检测报告。
生产企业应确保实施GB 9706.1标准和电磁兼容标准检测的产品一致,并与相关医疗器械检测机构及时沟通,通报问题,协助做好有关检测工作。不同医疗器械检测机构之间也应充分做好协调和沟通,监督企业做好有关工作。
对于检测过程中发现的重大问题,如基本性能判据、型号覆盖等问题,应在检测报告备注中详细载明有关问题并注明自身意见,以供具体技术审查部门参考。
四、各级食品药品监督管理部门应督促企业按照法规要求组织生产,并在注册审查过程中严格审查是否符合电磁兼容标准要求。
五、各具备电磁兼容标准承检能力的医疗器械检测机构应充分预估检测量,加大电磁兼容检测实验室建设,加强内部管理,与企业充分沟通,合理选择检测方法,提高检测效率,确保注册检测项目和其他医疗器械检测机构分包检测项目在合同约定时限内完成。
国家食品药品监督管理局鼓励各医疗器械检测机构积极与外系统相应优质电磁兼容实验室资源开展合作共建,并将对有关电磁兼容检测项目认证申请予以尽快处理。
六、在电磁兼容标准实施过程中,如出现不同医疗器械检测机构或技术审评部门等单位对标准条款、要求理解不同等影响标准全面实施的整体性、共性问题,相关单位可向国家食品药品监督管理局医疗器械标准管理中心提出申请,由其根据情况,决定是否启动专家咨询机制,并按程序经专家咨询提出解决建议,报国家食品药品监督管理局医疗器械监管司。
七、检验诊断类医用电气设备执行GB/T 18268.1:2010《测量、控制和实验室用的电气设备 电磁兼容性要求 第一部分:通用要求》标准,可参照本实施通知执行。
各级食品药品监督管理部门应加强协调,保证有关工作的落实,确保标准得以顺利实施。


文字版新闻:为了保证标准的顺利实施,国家局已配套发布了《关于印发YY 0505-2012医疗器械行业标准实施工作方案的通知》 (食药监办械[2012]149号)和《关于YY 0505-2012医疗器械行业标准实施有关工作要求的通知》(食药监办械[2012]151号),明确了标准实施的有关具体要求和时间安排等。迄今,国家局已按程序认可了北京市、上海市、广州市、天津市、杭州市、武汉市医疗器械质量监督检验中心、江苏省、深圳市医疗器械检测所等医疗器械检测机构按照该标准,从事医用电气设备开展电磁兼容性检测的能力,为相关产品检测提供了技术保障。
从目前初步统计情况看,该标准的实施,将会涉及国内外3-4千家医疗器械生产企业的约11000余个医用电气设备。作为产品安全的第一责任人,生产企业应该高度重视标准的发布实施,积极学习新标准,在研发、生产等全过程中贯彻新标准,确保产品符合新标准要求。食品药品监督管理部门将按规定做好标准实施后有关监督检查工作,对安全指标达不到要求的产品依法依规予以处理。
通过该标准的实施,必将进一步提高我国医用电气设备的安全性和有效性,保护公众的健康和安全,同时可以淘汰落后产品,促进产品更新换代,提升我国医用电气设备整体的产品质量和市场竞争力,推动我国医疗器械行业健康发展。


1、为什么推行要医疗器械YY0505电磁兼容标准?
YY0505标准规定的是医用电气设备需要符合电磁兼容标准要求,标准的执行程度直接关系到医疗安全和病患生命安全,社会和科技的发展,随之带来的是很多电子医用设备潜在的风险问题,比如X射线机工作发出的X射线,人长时间暴露在射线下,会引起多种问题,还有病患在手术麻醉过程中,如出现医用电子设备互相干扰,到时候麻醉机、呼吸机等不正常工作,会波及病人安全,更直接例如心脏起搏器,血液透析仪等,一旦不正常工作,后果很严重。YY0505标准额实施,既是对设备安全工作的要求,也是对医院病患正常使用医用设备的保证。


2、YY0505标准的内容
(1)YY0505标准引用了7个17626系列标准,具体包括:GB17626.3射频辐射抗扰度、GB17626.6射频传导抗扰度、GB17626.2静电放电、GB17626.4电快速瞬变脉冲群、GB17626.11电压跌落、GB17626.5雷击浪涌、GB17626.8工频磁场;
(2)YY0505标准还引用了GB17625.1和GB17625.2两个标准;
(3)发射类标准引用了GB4824标准;
(4)另外体外诊断类设备(IVD)参考GB18268.26标准,医用实验室诊断设备参考GB18268.1标准;


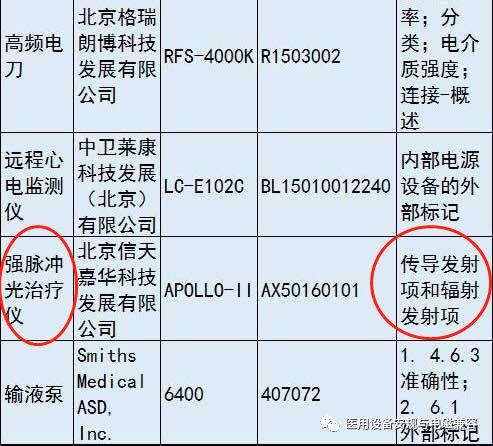
北京市药监局发布了《2016年下半年北京市医疗器械质量安全公告》
其中已经有企业因为电磁兼容项目抽检不合格而被处罚。


另外国内目前医疗器械EMC药监检测实验室整理
检验中心 | 中心地址 |
上海市医疗器械检测所 | 上海市浦东新区国际医学园区金银花路1号 |
中国食品药品检定研究院 | 北京市天坛西里 2 号 |
天津医疗器械质量监督检验中心 | 天津市西青区海泰华科大街5号( 300384) |
山东医疗器械产品质量检验中心 | 济南市高新区天泺路99号(250101) |
江苏省医疗器械检测所 | 江苏省南京市建邺区康文路17号(210022) |
浙江省医疗器械检验院 | 浙江省杭州市环城东路23号(310009) |
湖北医疗器械质量监督检验中心 国家武汉医用超声波仪器质量监督检验中心 | 湖北省武汉市洪山区中北东路24-9号(430077 ) |
重庆医疗器械质量检测中心 | 重庆市渝北区松牌路98号(重庆科技检测中心院内) |
陕西省医疗器械检测中心 | 陕西省西安市高新六路11号 (710075) |
辽宁医疗器械检验所 | 辽宁省沈阳市浑南高新技术产业开发区高荣路5号(110179 ) |
广东省医疗器械质量检测中心 | 广东省广州市寺右新马路寺右中街9号(510600) |
深圳市药品监督管理局 | 深圳市南山区高新区中区高新中二道28号 |
安徽省食品药品检验所 | 安徽省合肥市包河工业区包河大道与 乌 鲁 木 齐路交界处(230051) |
四川省食品药品检验检测院 | 四川省成都市高新西区新文路8号(611731) |




