化学电池材料
本文摘要(由AI生成):
本文主要介绍了新能源材料的分类、作用、发展历史以及应用。新能源材料包括传统能源材料、新能源材料和节能材料等。新材料能够将习用已久的能源变为新能源,提高储能和能力转化效果,决定核反应堆的性能与安全性,并影响投资与运行成本。化学电池的发展历史包括燃料电池和PEMFC的工作原理。金属双极板和复合双极板是制作PEMFC双极板的首选材料之一,但金属双极板面临腐蚀问题。镍氢电池具有能量密度高、无镉污染、可大电流快速充放电等优势,在小型便携式电子器件中获得了广泛应用。复合材料在锂离子电池中具有优异的电化学性能和循环性能。
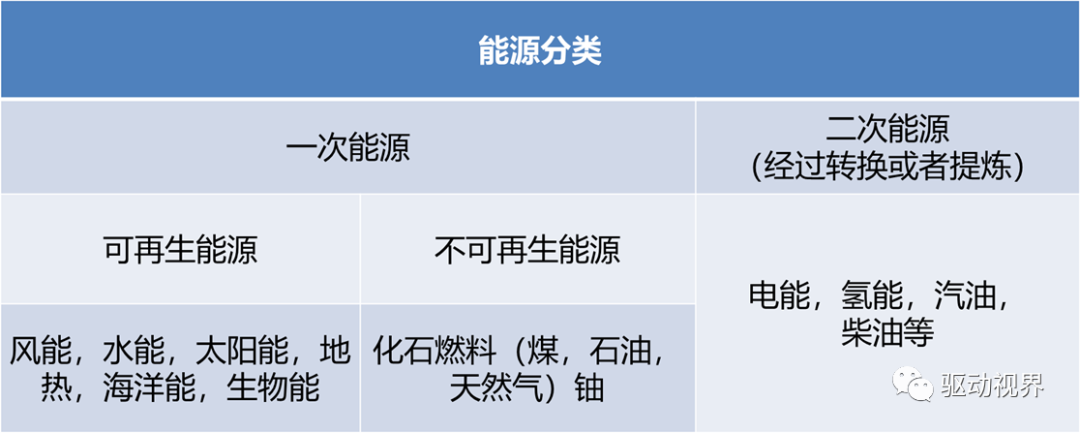
新能源的分类
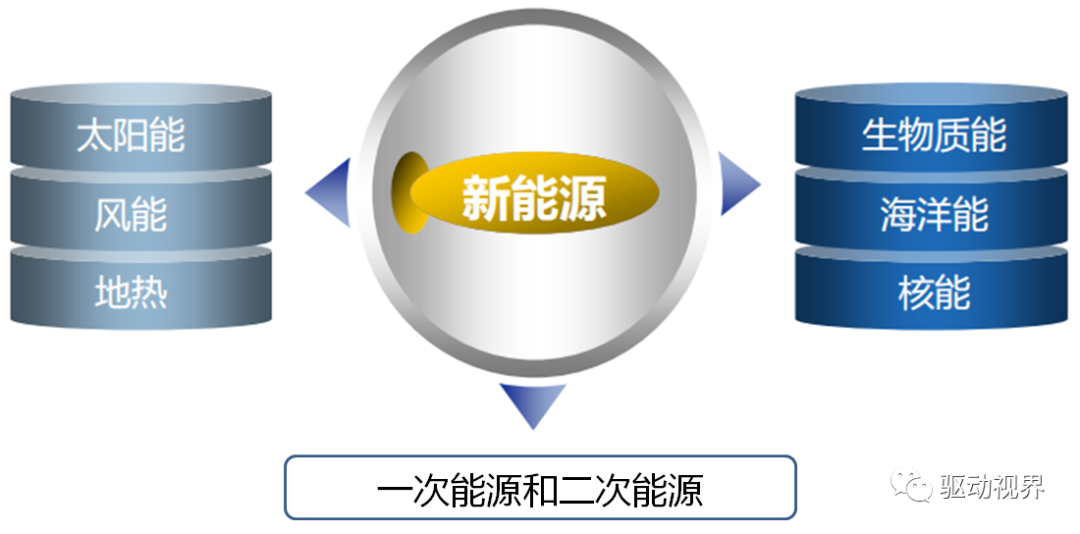
能源材料定义
广义上,凡能源工业及能源利用技术所需的材料都可称为能源材料。
又可以按使用率和具体功能分为以下几种:
传统能源材料:煤、石油、天然气等ü新能源材料:如增殖堆用核材料、太阳能电池材料
节能材料:如非晶态金属磁性,超导材料
储能材料:如贮氢(吸氢)材料,高比能电池材料
新能源材料的作用
新材料把原来习用已久的能源变为新能源。
如:半导体材料把太阳能有效地直接转变为电能;燃料电池能使氢与氧反应而直接产生电能,代替过去利用氢气燃料获得高温。
一些新材料可提高储能和能力转化效果。
如:镍电池、锂离子电池等都是靠电极材料的储能效果和能量转化功能而发展起来的新型二次电池。
新材料决定着核反应堆的性能与安全性。ü材料的组成、结构、制作、加工工艺决定着投资与运行成本。
如:太阳电池材料决定着光电转换效率;燃料电池的电极材料决定着电池的质量和寿命;材料的制备工艺又决定着能源的成本。
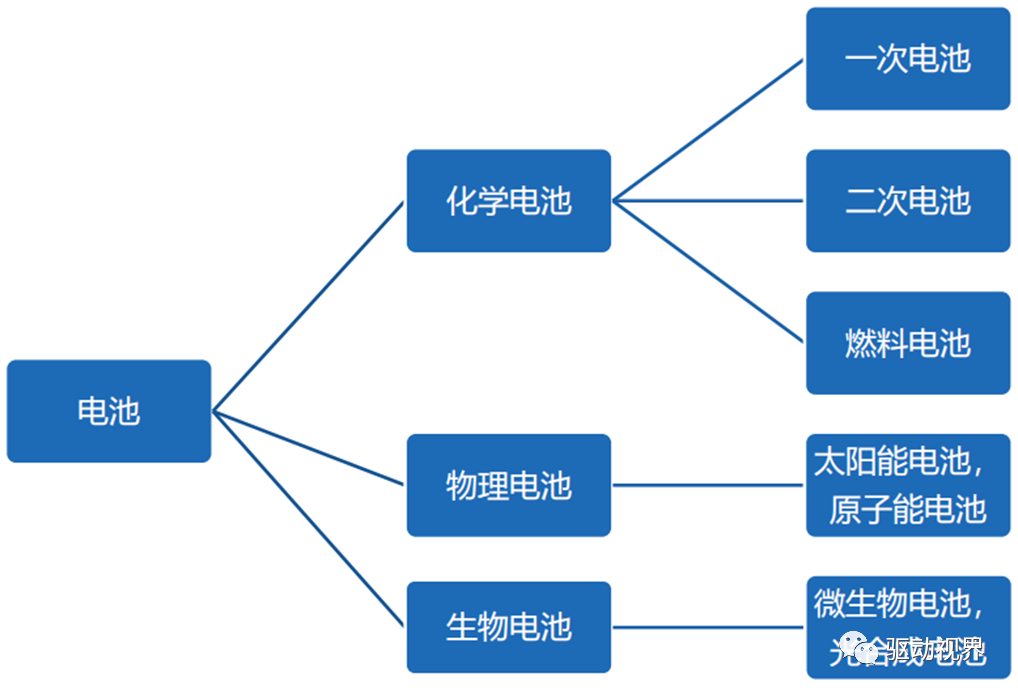
化学电池发展历史
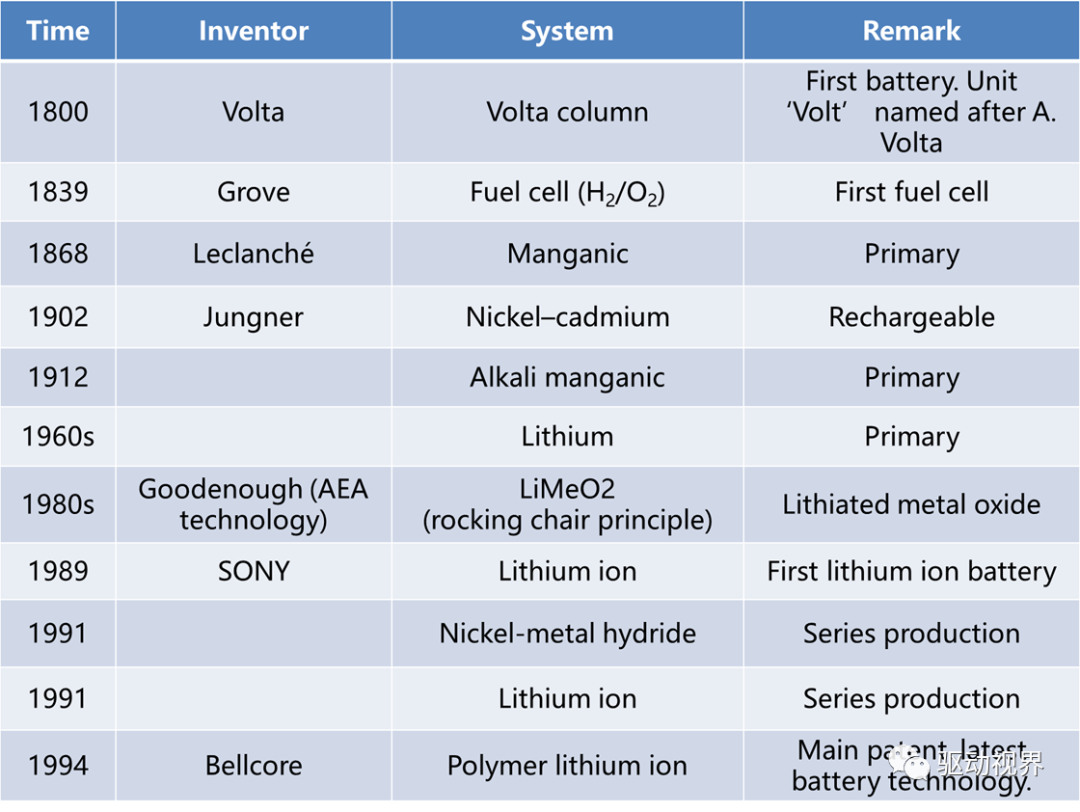

化学电池的组成
一般燃料电池所具有的高效率、无污染、无噪声、可有功率密度高、工作温度低、启动快、使用寿命长等优点。
在固定电站、电动车、军用特种电源、可移动电源等方面都有广阔的应用前景,已引起越来越多国家和企业的重视,都纷纷斥巨资于这一项目,目前已接近于商业化应用。
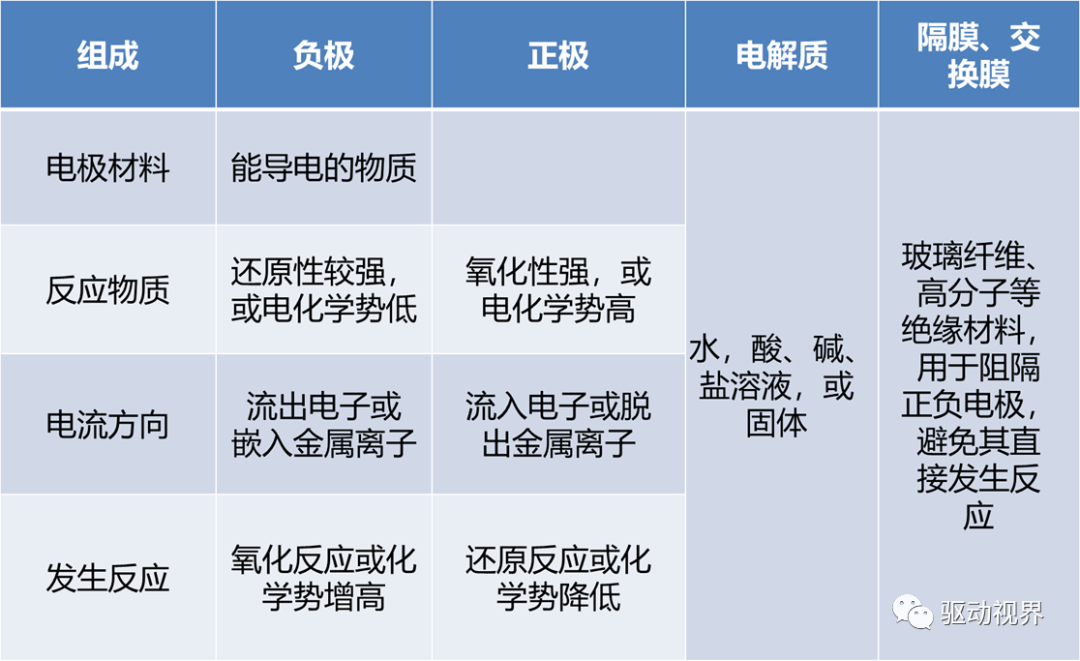
燃料电池的分类
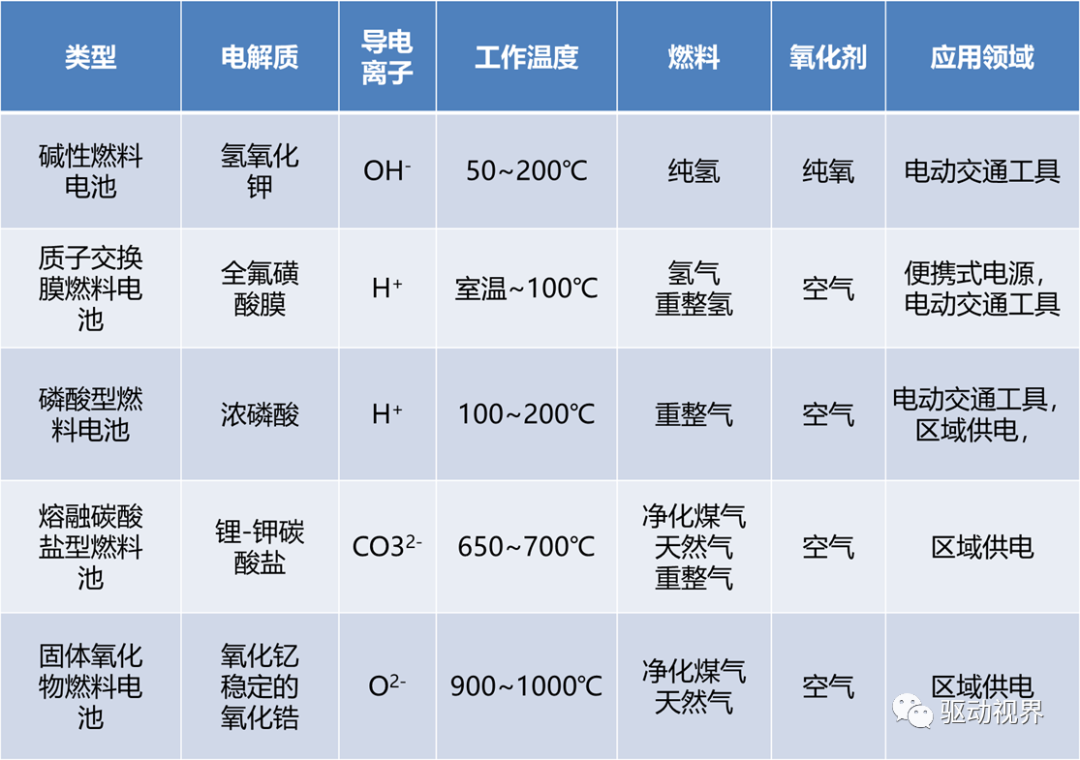
燃料电池的规模
全球燃料电池产业规模持续扩大,便携式电池和小型固定式电池应用更加普及。
主要由北美主导,其次是欧洲和日本,然后是韩国和中国。
燃料电池的发展
1. 六十年代碱性燃料电池曾迅速发展并在航天领域得到应用。
2. 七十至八十年代,熔融碳酸盐燃料电池和固体氧化物燃料电池发展起来。
3. 九十年代以来,质子交换膜燃料电池得到迅猛发展。
4.把燃料电池应用到汽车上是一个历史性的突破,这种电动汽车的最大好处是灵敏度高,不会因汽车尾气等造成环境污染。
5. 燃料电池应用速度加快,氢能燃料站持续增加。
质子交换膜燃料电池(PEMFC)的结构
1.一个PEMFC本体由若干个电池单体组成,每个电池单体又包括双极板、电极/铂催化剂和质子交换膜等部件。
2.除了PEMFC本体外,PEMFC系统还包括燃料及其循环系统、氧化剂及其循环系统、水/热管理系统等辅助系统。
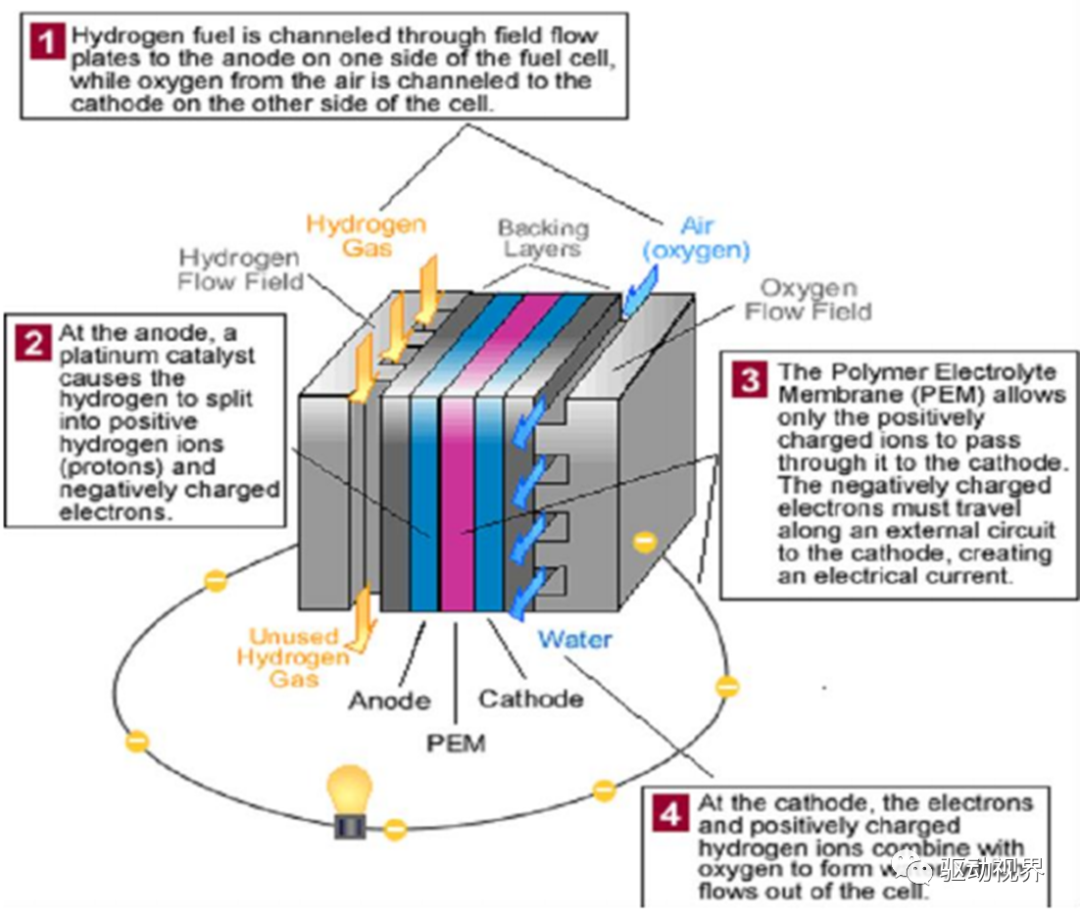
PEMFC的工作原理
PEMFC的工作原理如下(以氢气为燃料,以氧气为氧化剂):增湿后的氢气通过双极板上的气体通道穿过阳极扩散层,到达电池的阳极催化剂层,并吸附于催化剂层中。
1.吸附于阳极催化剂层中的氢气在铂催化剂的作用下,发生阳极反应,在阳极上产生电子。
2. H2 → 2H 2e- 或:nH2O 1/2H2 → H ·nH2O e-
3. 随后,H 或H ·nH2O进入质子交换膜,通过与膜中磺酸基上的H 进行质子交换到达电池阴极。与此同时,增湿的氧气也穿过双极板上的气体通道和扩散层,吸附于阴极电催化剂层中。
4.吸附于阴极催化剂中的氧气与交换而来的H 在铂催化剂的作用下,发生阴极反应:
1/2O2 2H 2e → H2O
在阴极上电子被吸收,阳极氢在较低电位下氧化,阴极氧在较高电位下还原,两极间产生电位差,将外电路连接就会形成电流,向外电路输出电能理论上PEMFC的转化率可超过80%
质子交换膜燃料电池的关键技术
PEMFC的关键技术包括质子交换膜、电催化剂和膜电极的制备,双极板表面流场的加工和极板材料的选择,以及燃料、氧化剂的使用和水热管理等。
目前制约PEMFC商业化的主要因素是电催化剂、电解质膜和双极板等部件的成本太高,为解决这一问题,国内外学者都进行了大量研究。
质子交换膜
质子交换膜(PEM)是PEMFC的一个核心组成部分,它主要起分隔燃料/氧化剂和传导质子的作用。
目前,国内外应用最广的仍然是全氟磺酸材料制成的PEM,如Nafion膜和Dow膜等。
20世纪70年代初由美国Dupont公司推出的Nafion全氟磺酸质子交换膜在离子导电性、电子绝缘性、机械强度以及机械气密性和电化学稳定性等方面均能达到实用要求,寿命长达10年。
电催化剂
在PEMFC中,催化剂的类型决定于所用的燃料。
目前,燃料电池多使用甲醇或甲醇重整气为燃料,这两种燃料中都含有CO。
CO在催化剂表面的强化学吸附,可导致催化剂的活性表面全部被CO占据,需要的反应不能正常进行,造成催化剂CO中毒。
克服催化剂中毒的方法
克服CO中毒的方法:燃料重整法和催化剂合金化法燃料重整法包括实际工作条件下很难维持的选择性氧化法,如Ballard公司通过在铝上的催化剂铂(Pt)传递重整的甲醇和少量氧气,降低燃料电池中的CO含量至0.01%,和在有充足H2通入的情况下,在阳极增湿器通入H2O2
催化剂合金法是将一种或两种元素加入到基础催化剂中,将催化剂制成合金,克服CO的中毒。
为了解决催化剂的CO中毒问题,催化剂研究主要集中在PtM(M是某种贵金属或过渡金属)二组分合金和三组分合金方面。
二组分合金
在二元阳极催化剂中,PtRu/C是应用最为广泛,也是较为成熟的抗毒化催化剂,PtRu/C具有较高的活性及稳定性,它可以在低电
位下氧化CO 。
催化原理:在低电位Ru的表面上可以吸附含氧物,将邻近的吸附在Pt上的CO氧化成CO2,Pt的活性点得以空出,供燃料分子的吸附和氧化,从而提高燃料氧化的速率和效率。
三组分合金
三元催化剂主要以Pt、Ru合金为基础。
Holleck等发现,三元催化剂Pt0.53-Ru0.32-W0.15合金在低电压和高电压区域都较二元有着更好的性能。
Pinheiro等分析了Pt、Ru、Pt、Mo和Pt-Ru-Mo/C的性能,发现三元催化剂性能最佳。
Chen等对WO3加入催化剂的情况进行了研究,结果表明WO3的加入使Pt/WO3和Pt/Ru/WO 对甲醇及H/CO的催化活性都有所提高。
Pt-Ni/C,Pt-Co/C,Pt-Cd/C在PEMFC中对电极动力学性质的影响进行了考察,结果显示3种合金催化剂都优于纯Pt催化剂
催化剂举例
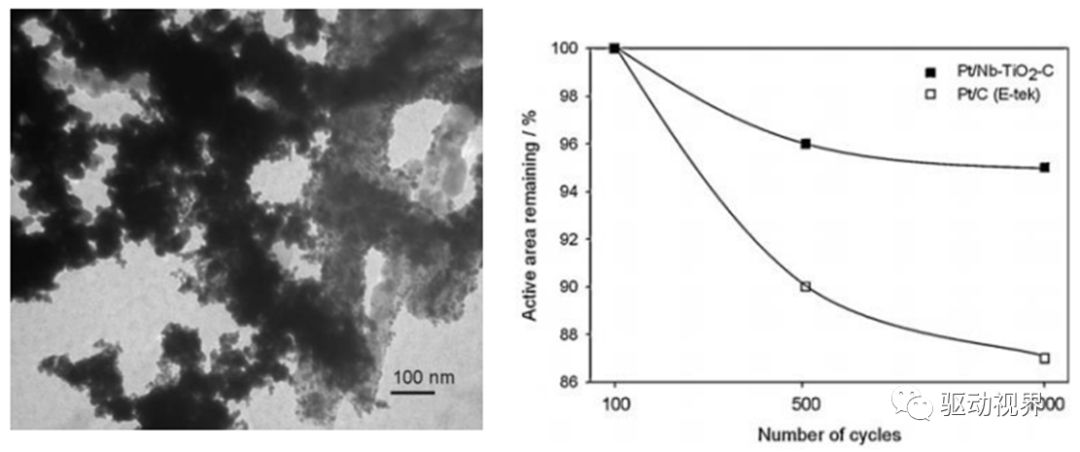
Application of a compositestructure of carbon nanoparticles and Nb-TiO2 nanofibers as electrocatalystsupport for PEM fuel cells
——A. Bauer et al. / Journal ofPower Sources 210 (2012) 15– 20
膜电极
膜电极三合一组件(MEA)主要由质子交换膜、气体扩散层和电催化层三部分组成,对PEMFC的输出功率、能量密度分布及工作寿命有着决定性的影响。
其中膜主要有Nafion膜、有机/无机杂化聚合物电解质膜等扩散层的作用在于支撑催化层,收集电流,并为电化学反应提供电子通道、气体通道和排水通道,通常使用碳纸或者碳布催化层则是电化学反应发生的场所,目前多采用Pt催化剂。
目前人们已经开发出多种膜电极制备工艺以减少电极的Pt载量,如涂膏法、浇注法、滚压法和电化学催化法等。
双极板
双极板作为PEMFC的主要的结构和功能部件,目前其成本太高是制约燃料电池商业化的一个重要因素。
文献表明,一个典型的双极板占整个电堆质量和体积的80%,成本的46%。
因此,对双极板材料及其制作工艺的开发是提高性能,降低 制造成本的主要途径之一双极板是PEMFC的一个多功能的组成部件,除了起支撑膜电极和在两个单体电池间集流导电的作用外,还有导通气体、排水和传热等作用。
双极板材料的要求
双极板应具有以下性能:电阻率<0.01Ω·cm2
1. 热导率尽量高
2. 氢气渗透率<10-4cm3/s.cm2
3. 腐蚀速率小于0.016mA/cm2
4. 抗压强度>0.15MPa(6) 密度<5g/cm2。
目前,PEMFC双极板材料大致可分为碳(石墨)材料、金属材料和复合材料。
石墨双极板材料有完全石墨化材料和碳复合材料两种
主要优点是具有好的耐蚀性、导电性和导热性、接触电阻小以及密度低等。
以石墨为双极板材料制成的PEMFC是目前各种双极板材料制得的PEMFC中放电性能最好的,常被用作开发其它新材料双极板的参照体系。
缺点也较明显:如孔隙率大、机械强度低、加工性能差等。
金属双极板
与石墨双极板相比,金属材料的强度高、加工性能好,可制成很薄的双极板以制造重量比能量和体积比能量都很高的PEMFC,金属的气体不透过性能够阻隔氧化剂和还原剂,因此金属材料是制作双极板的首选材料之一。
目前已研究的金属双极板材料主要包括不锈钢、钛、铝、镍等。
金属双极板面临的主要问题是在PEMFC环境中的腐蚀问题。
金属的溶解会污染膜电极,而金属表面钝化膜的形成则又会增大接触电阻,从而降低电池性能。
复合双极板
无孔石墨双极板石墨化费工时、成本高,而长寿命金属双极板必须进行表面改性处理。
为了充分利用石墨和金属材料的特点,已开发了以金属基多孔石墨、聚碳酸酯塑料和不锈钢为材料的复合双极板。
与无孔石墨板相比,制造多孔石墨便宜、省时,只要不锈钢和聚碳酸酯部分能保证气体不渗透,就可使用多孔石墨。
石墨耐腐蚀,不锈钢能提供机械强度,聚碳酸酯能提供化学稳定性,并能被浇铸成各种形状的密封圈。
复合材料的优点在于成型制备快,体积小,重量轻,耐蚀性能好。缺点是导电性差,机械性能差。
燃料电池的应用

直接甲醇燃料电池,属于质子交换膜燃料电池,使用液态甲醇为燃料,相比较质子交换膜燃料电池,DMFC低温生电、燃料成分危险性低、结构简单DMFC的效率仍然不如现有的电池技术


我国首条氢燃料电池公交示范线,2006年6月开始运行于北京中关村附近,票价2元。
由奔驰公司生产,每辆价值180万美元。

德国在HDW基尔船厂将世界上第一艘现代非核潜艇命名为U31号
新式潜艇在水下巡游数周时间而不必升出水面,而常规柴电潜艇巡游两天时间就会用尽电能。
燃料电池用作舰载电池,用多个燃料电池分别为不同的舰载系统供电,避免一旦集中式供电系统受损全舰都无法工作。
此外,燃料电池没有噪音,而且不会放出热量;这些因素有助于潜艇不会被发现。
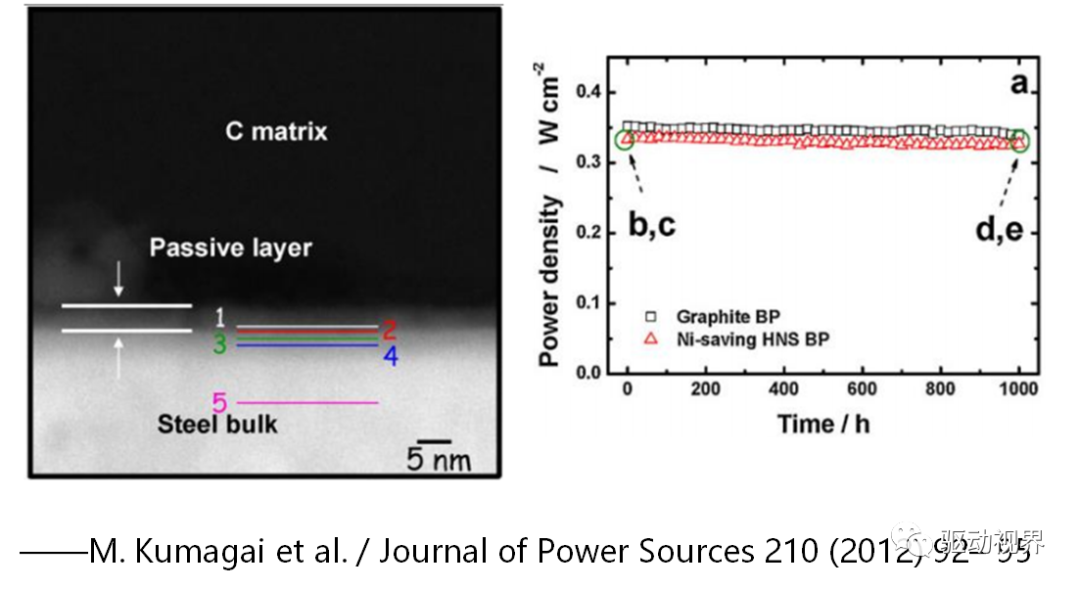
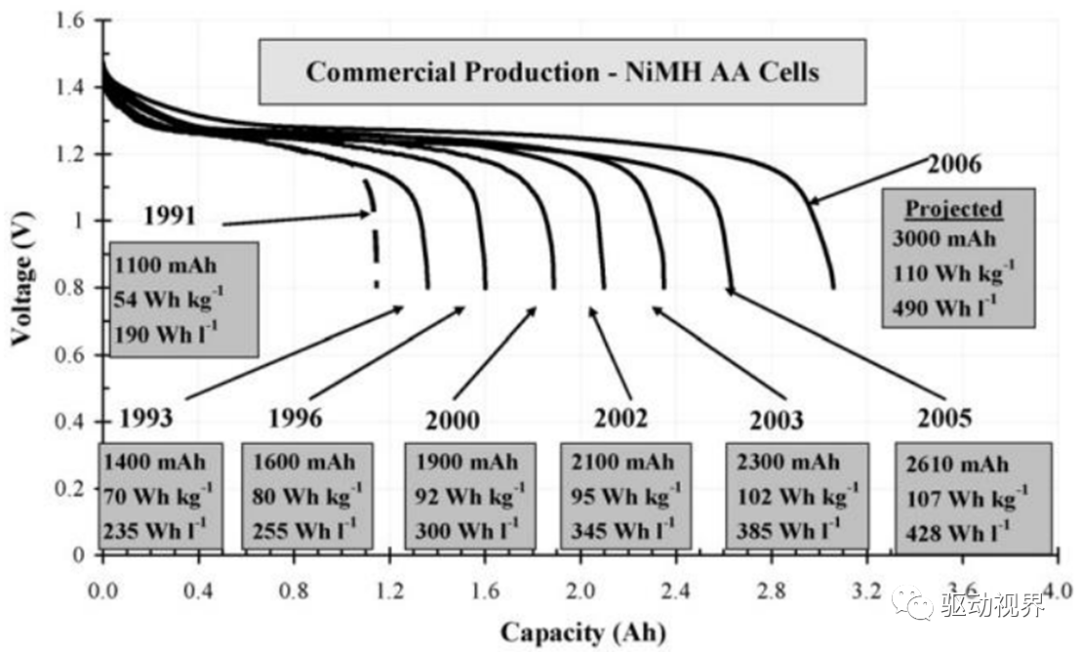
镍氢电池发展
Recent advances in NiMH batterytechnology
——Journal of Power Sources 165(2007) 544–551
摘要:1991年首个镍氢电池诞生,当时镍氢电池的比容量从54Whkg−1,而目前的商用电池比容量达到了100Whkg−1。
由容量为30mAh的电池单元组成250Ah电池已经应用于电动bus,6Ah电池应用于电动汽车(EV)。
而且现在的镍氢电池应用的温度范围也得到了大大地提高,在-30℃-70℃范围内,依然能够保持90%以上的容量。
而这些提高得益于金属氢化物和氢氧化镍材料的性能改进。
镍氢电池材料
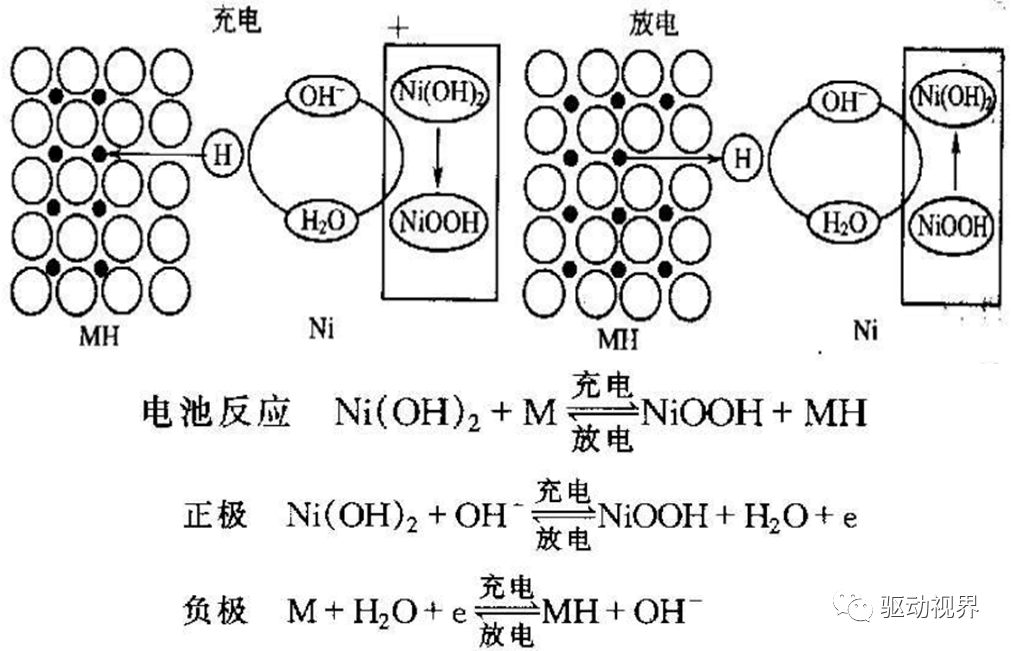
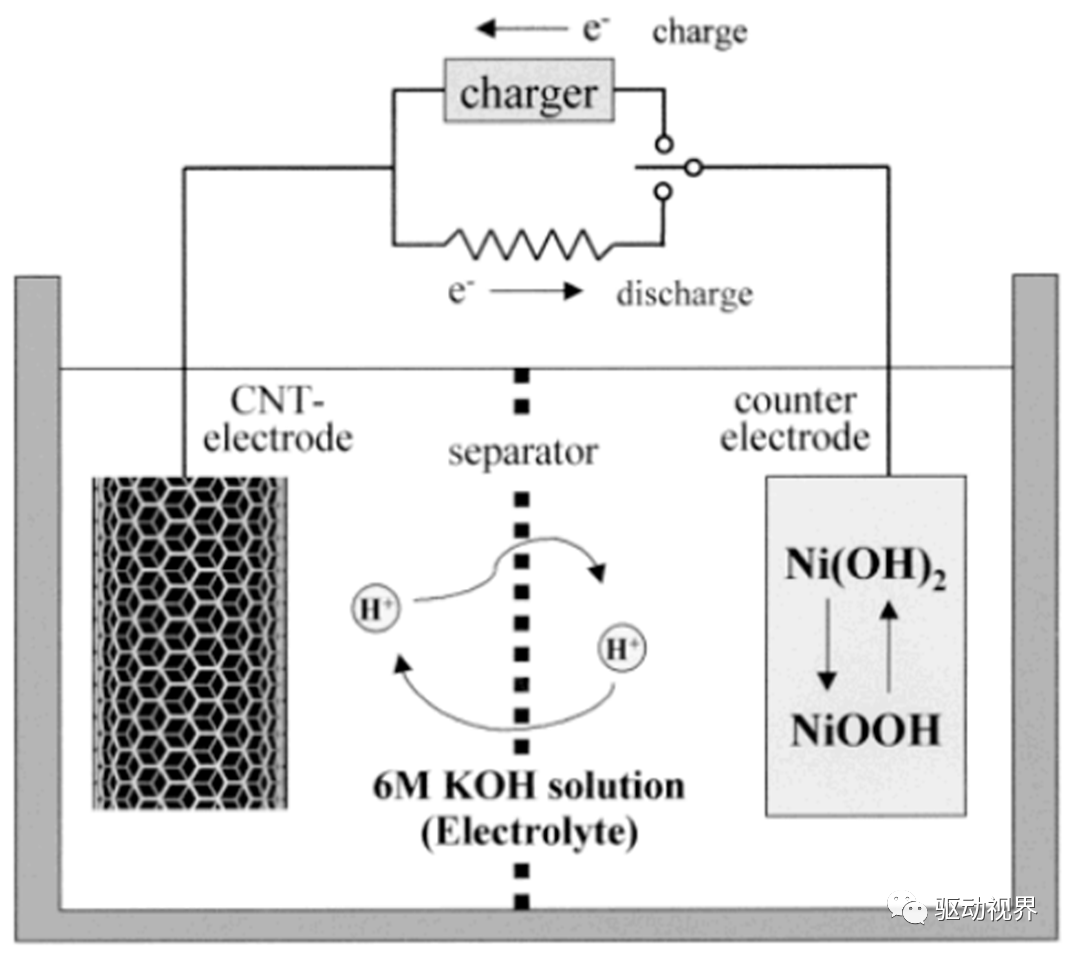
从图可以看出:
利用氢的吸收和释放的电化学可逆反应;
正电极采用氧化镍物质,负电极采用吸收氢的合金;ü电解质由水溶液组成,其主要成分为氢氧化钾。KOH电解质不仅起离子迁移电荷作用,而且参与了电极反应。
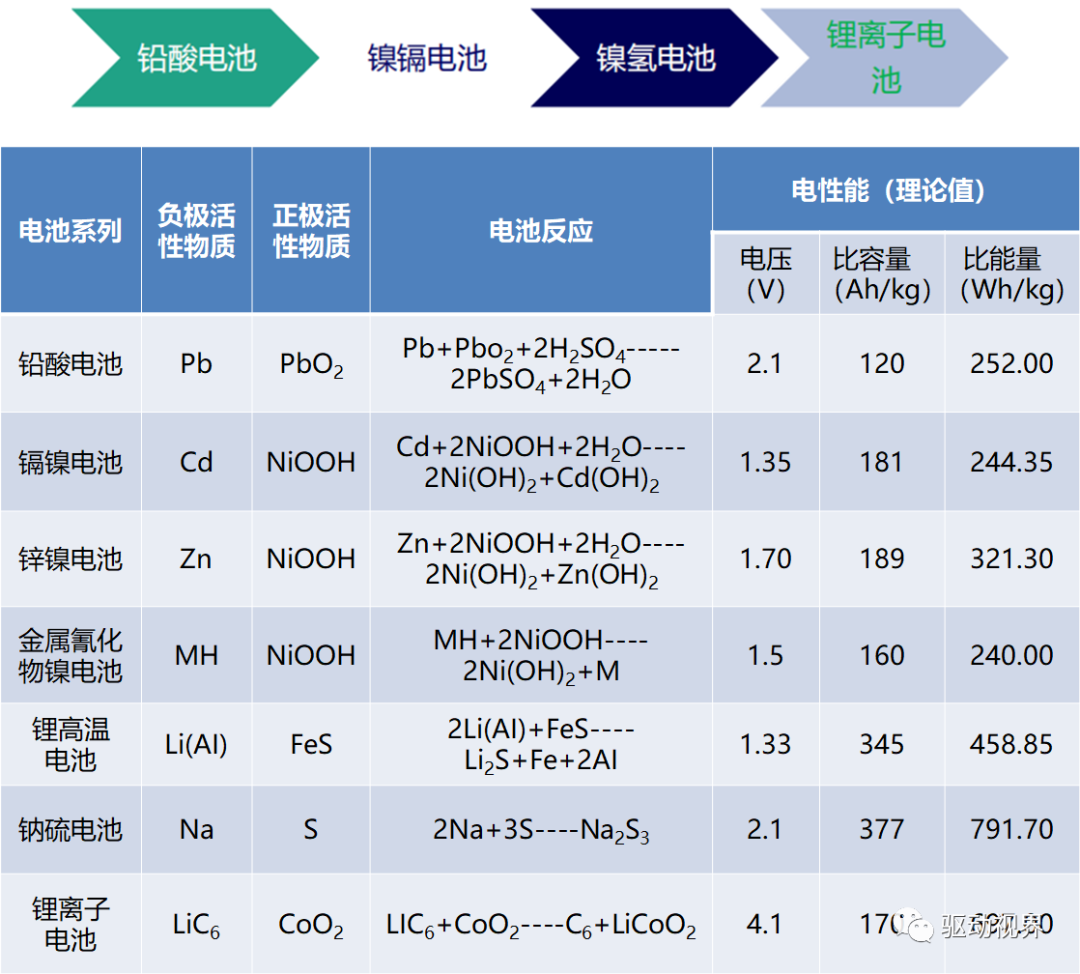
镍氢电池材料
正极材料 - 球形Ni(OH)2
正极材料Ni(OH)2是涂覆式Ni/MH电池正极使用的活性物质。
电极充电时Ni(OH)2转变成NiOOH,Ni2 被氧化成Ni3 放电时NiOOH逆变成Ni(OH)2, Ni3 还原成Ni2 。
负极材料-储氢合金(MH)、其他储氢材料
用于Ni/MH电池负极材料的储氢合金应满足下述条件:
(a)电化学储氢容量高;
(b)在热碱电解质溶液中合金组分的化学性质相对稳定;
(c)反复充放电过程中合金不易粉化;
(d)合金应有良好的电和热的传导性;
(e)原材料成本低廉。
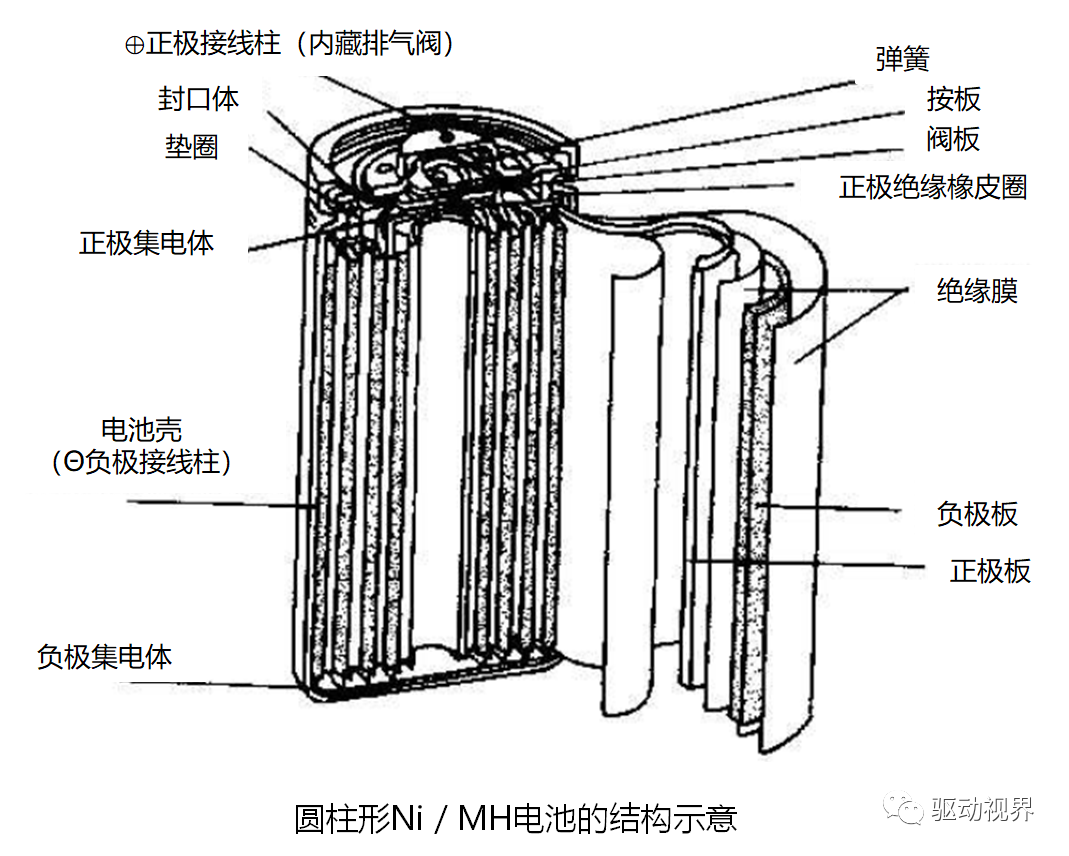
镍氢电池结构
镍氢电池发展优势和应用
(a) 能量密度高;
(b) 无镉污染,是绿色电池;
(c) 可以大电流快速充放电;
(d)Ni/MH电池的工作电压也是1.2V,与Ni/Cd电池具有互换性等独特优势。
在小型便携式电子器件中获得了广泛应用,在电动工具、电动车也正在逐步得到应用。

储氢方式比较

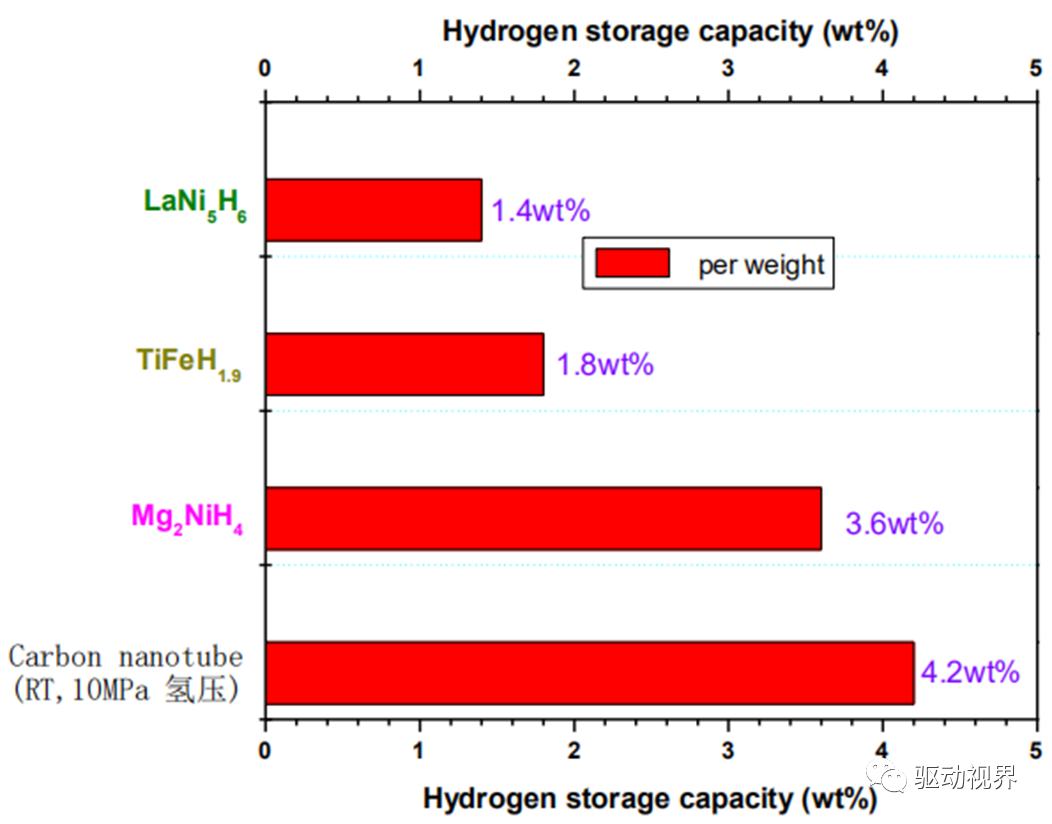
储氢材料现状
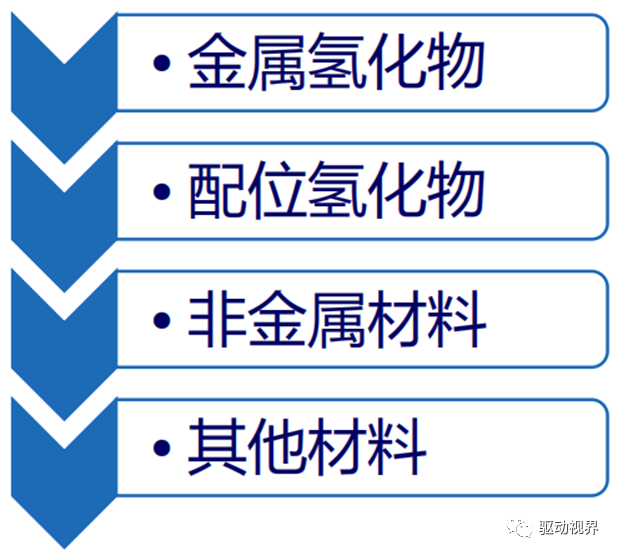

稀土镧镍系
典型代表:LaNi5 ,荷兰Philips实验室首先研制ü特点:
活化容易
平衡压力适中且平坦,吸放氢平衡压差小
抗杂质气体中毒性能好
适合室温操作ü经元素部分取代后的MmNi3.55Co0.75Mn0.47Al0.3(Mm混合稀土,主要成分La、Ce、Pr、Nd)广泛用于镍/氢电池
钛铁系
典型代表:TiFe,美Brookhaven国家实验室首先发明具有以下特点:
价格低
室温下可逆储放氢
易被氧化
活化困难
抗杂质气体中毒能力差
实际使用时需对合金进行表面改性处理
镁系
典型代表:Mg2Ni,(美)Brookhaven国家实验室首先报道
储氢容量高
资源丰富
价格低廉
放氢温度高(250-300℃ )
放氢动力学性能较差
改进方法:机械合金化-加TiFe和CaCu5球磨,或复合
钛/锆系
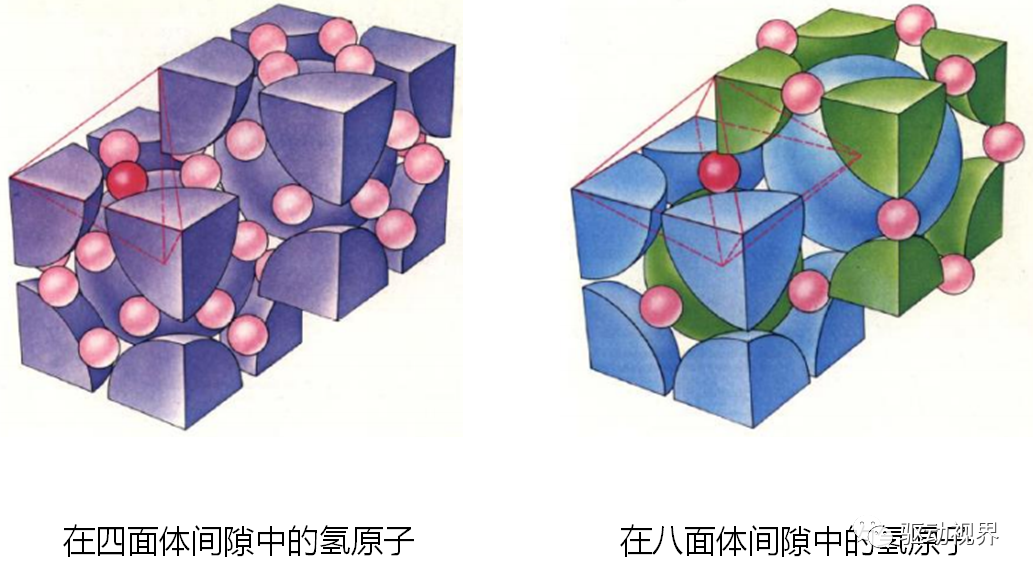
具有Laves相结构的金属间化合物ü原子间隙由四面体构成,间隙多,有利于氢原子的吸附
TiMn1.5H2.5日本松下(1.8%)
Ti0.90Zr0.1Mn1.4V0.2Cr0.4
活性好
用于:氢汽车储氢、电池负极Ovinic
配位氢化物
碱金属(Li、Na、K)或碱土金属(Mg、Ca)与第三主族元素(B、Al)形成
储氢容量高
再氢化难(LiAlH4在TiCl3、 TiCl4等催化下180℃ ,8MPa氢压下获得5%的可逆储放氢容量)
纳米碳管储氢

纳米碳管电化学储氢
其他材料
除了以上三类材料外,一些无机化合物和铁磁性材料也可以作为储氢材料。
如:KHNO3、NaHCO3、Fe3O4等。
锂离子电池材料
由于其工作电压与重量能量密度优于常用的镍镉电池(Ni/Cd)与Ni/MH电池,又无记忆效应及环保问题(锂离子电池的金属含量最低),因此成为目前商业开发二次电池的主流;还以其薄形化及形状有高度的可塑性等特点,因此符合电子产品轻、薄、短、小的要求,所以备受各国科学家及电池业的重视,发展极快。
锂离子电池被人们称为“绿色环保能源”和“跨世纪的能源革命”。
锂离子电池是照相机、电子手表、计算器、各种具有储存功能的电子器件或装置的理想电源。
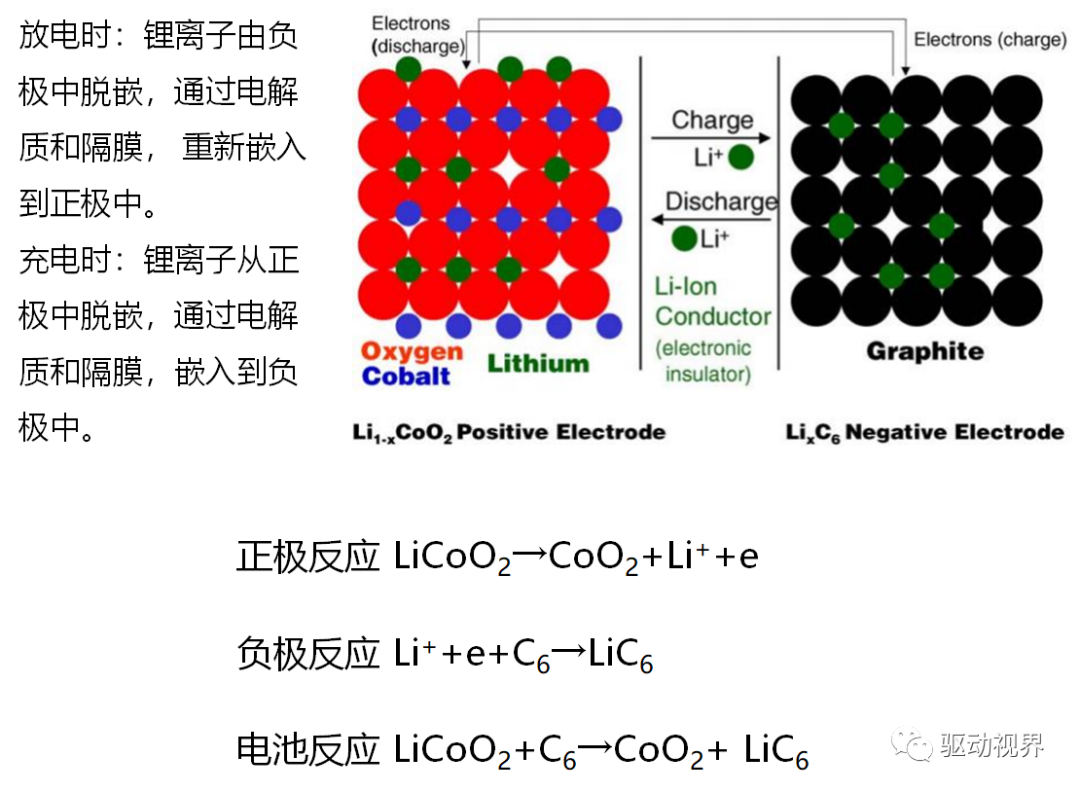
锂离子电池原理
锂离子电池的结构
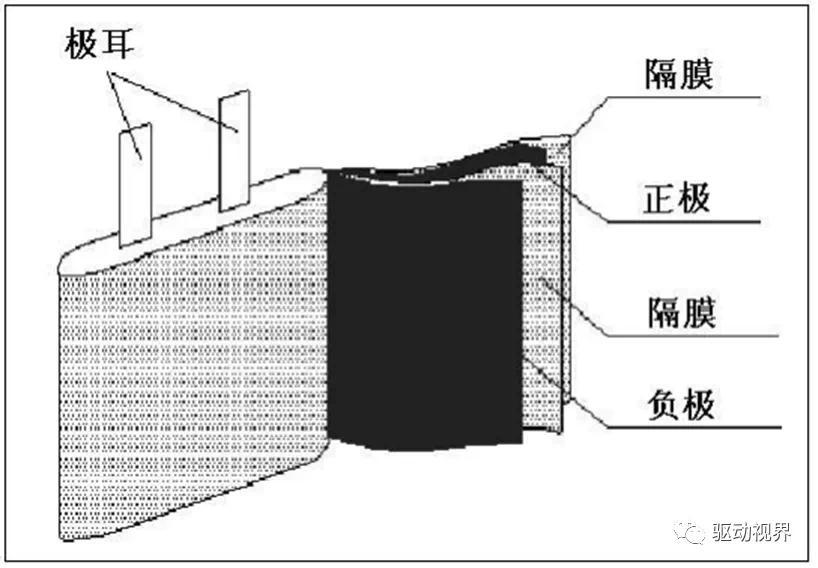
锂离子电池由正负电极、电解质、隔膜和外部控制电路组成。
所以研究锂离子电池材料包括:电极材料、电解质材料和隔膜材料。
负极材料要求
(1)锂贮存量高。
(2)锂在碳中的嵌入脱嵌反应快,即锂离子在固相的扩散系数大,在电极-电解液界面的移动阻抗小。
(3)锂离子在电极材料中的存在状态稳定。
(4)在电池的充放电循环中,碳负极材料体积变化小。
(5)电子导电性高。
(6)碳材料在电解液中不溶解。
负极材料的选择对电池的性能也有很大的影响。
而最常用的是石墨电极,因为石墨导电性好。
结晶度较高,具有良好的层状结构。
适合锂的嵌入\脱出。
而且它的插锂电位低且平坦,可为锂离子电池提供高的平稳的工作电压。
大致为:0.00---0.20v 之间(vsLi+/Li)
负极材料种类
碳石墨材料(石墨,碳纤维,碳素,裂解等,)
金属合金
金属氧化物(锡、铁、锰、镍、钴等过渡金属氧化物)
含锂金属氮化物
复合材料
碳负极材料
嵌锂容量高,其锂论容量为372mAh/g。
嵌锂电位低且平坦,为锂离子电池提供高而平稳的工作电压。
容量受溶剂的影响程度较大,与有机溶剂的相容能力差。
目前用石墨作炭负极的生产制造商主要有Panasonic(松下),Sanyo(三洋),Varta(瓦尔塔)等公司。
碳材料分类
软碳:软碳主要有石油焦、针状焦、碳纤维、碳微球等。其中,普通石油焦的比容量较低,约为160mAh/g,循环性能较差。
硬碳中主要有树脂碳(如酚醛树脂、环氧树脂、聚糠醇PFA—C等),有机聚台物热解碳(PVA、PVC、PVDF、PAN等)以及碳黑(如乙炔黑)等。
石墨:与普通碳材料相比,石墨的导电性和结晶性更好,因而得到最广泛的应用。石墨又分为人工石墨,天然石墨和改性石墨。
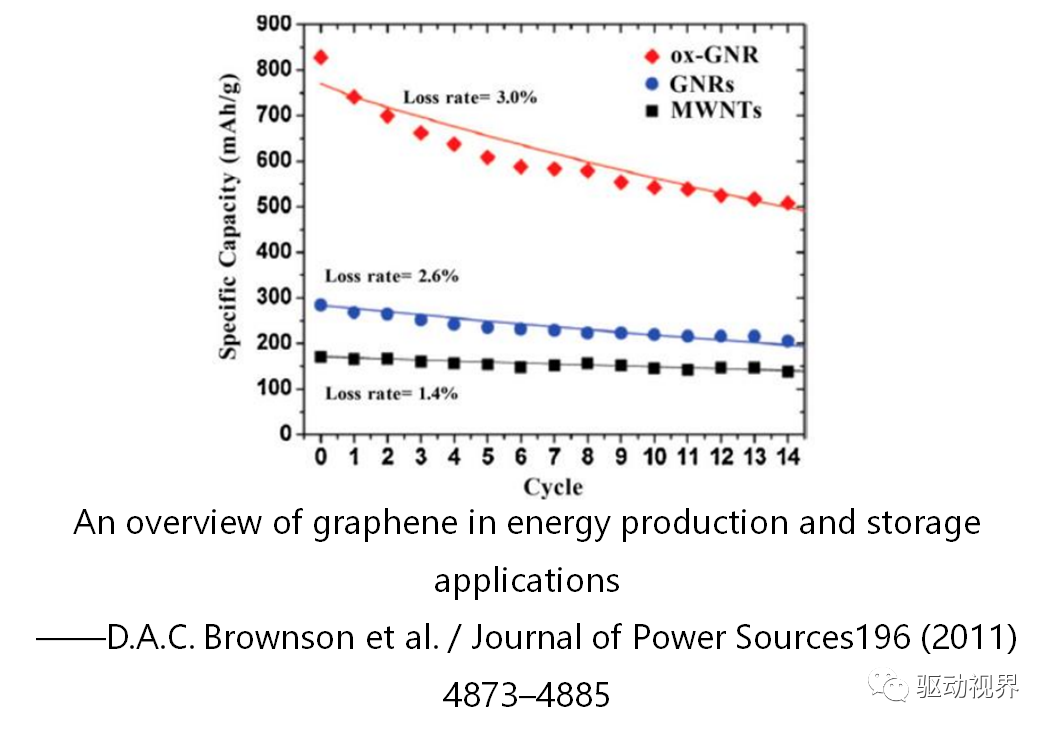
金属氧化物材料
过渡金属氧化物作为锂离子电池负极材料,因为其特殊的反应机理(不同于石墨等的嵌入和脱出)引起了广泛的关注。
6C LiCoO2 → Li1-xCoO2 LixC6 (1.)
MxOy 2yLi ↔ xM yLi2O (2.)
然而充放电过程中,金属氧化物团聚(粉化)引起较大的体积变化,造成较大的不可逆容量损失,仍然是限制其在更高要求应用(EV、UPS等)的障碍。
金属氧化物材料种类
目前正在研究的过渡金属氧化物种类有Fe,Ni,Co,Mn,Sn,Cu,Ti等,和传统石墨材料相比,具有非常高的理论容量。如:
锡的氧化物包括氧化亚锡、氧化锡及其混合物都具有一定的可逆储锂能力,可达500mAh/g以上,但首次不可逆容量大,循环衰减快。通过改进制备工艺条件以及通过向锡的氧化物中掺入B、P、Al及金属元素的方法可使不可逆容量和循环性能得到改善,但仍有待进一步改进和提高。
铁的氧化物包括α-Fe2O3、Fe3O4具有~1000mAh/g的理论容量。
金属合金材料
合金类负极材料一般高的比容量,典型的如Si、Sn、 Al、In、Zn、 Ge等,其中金属锡的理论比容量为990mAh/g,硅为4200mAh/g,远高于碳石墨的372 mAh/g。
但锂反复的嵌入脱出导致合金类电极在充放电过程中体积变化较大,逐渐粉化失效,因而循环性能很差。
复合材料
单种材料总是不能满足高容量和良好的循环性能。
比如金属氧化物具有很高的容量,然而其导电性差,以至于充放电过程能量损失大;而石墨材料导电性好,理论容量较低。
如果将两种材料复合,可以提高综合电化学性能。
常见的复合有掺入金属,与石墨、 硅、碳纳米管等复合。
复合材料举例
Fe3O4/Fe/Carbon Composite and ItsApplication as Anode Material for Lithium-Ion Batteries
—— Xiuyun Zhao.; Dingguo Xia.; KunZheng. ACS Appl. Mater. Interfaces 2011 , 3, 705 −709.
X i u y u n Z h a o 等, 用溶胶凝胶法 ,制备了果冻布丁状的Fe3O4/Fe/Carbon复合材料,具有优异的电化学性能,经过50充放电循环之后, 容量仍然保持在 600 m A h / g 以上 。
复合材料举例
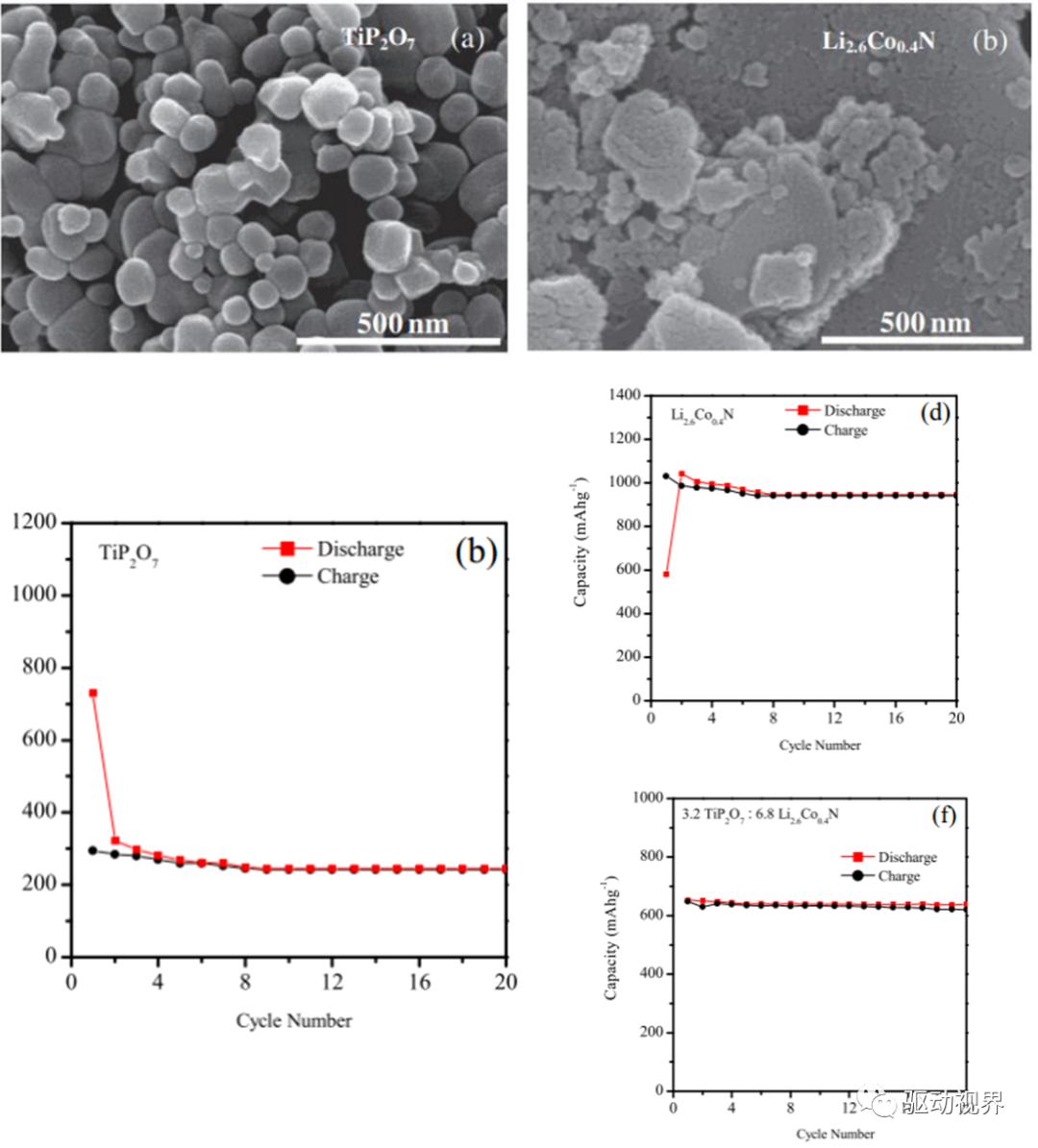
Alok Kumar Rai等,用共沉淀法制备了TiP2O7/Li2.6Co0.4N复合材料,以减少单一材料在使用中的容量损失,保持更好的循环性能。
制备的复合材料首次容量为652.57mAh/g,经过20次循环之后容量为647.54 mAh/g,库仑效率达到98%。
正极材料要求
(1)相对锂的电极电位高,材料组成不随电位变化,粒子导电率和电子导电率高,有利于降低电池内阻.
(2)锂离子嵌入脱嵌可逆性好,伴随反应的体积变化小,锂离子扩散速度快,以便获得良好的循环特性和大电流特性。
(3)与有机电解质和粘结剂接触性能好,热稳性好,有利于延长电池寿命和提高安全性能。
锂离子电池能有较高的电压,也和它的正极材料有很大关系。
因为锂离子电池负极常用相对于锂0—1V 的碳负极,因此要获得3V以上的电压 ,必须使用4V级(vsLi /Li)正极材料,而通过嵌入过程中吉布斯自由能变化的计算可知,正极电位与晶格能、离子化能、离子的溶剂化能有关.其中晶格能影响较大,因此,电池电压主要由正极结晶结构决定。
而尖晶石结构和层状结构的化合物一般电位较高,故常用作正极材料。
常见的尖晶石结构如:LiMn2O4,层状结构有:LiCoO2。
正极材料研究现状
Recent developments in cathodematerials for lithium ion
batteries
——J.W. Fergus / Journal of PowerSources 195 (2010) 939–954
正极材料面临的挑战在于扩充容量和适应快速充放电(高倍率放电)。
基于α-NaFeO2尖晶石结构的过渡金属氧化物显示了很好的前景,然而在成本控制和使用寿命(循环性能)上仍需改善。
本文综述了目前研究最有前景的材料,并且讨论了性能改善方法。
正极材料是典型的过渡金属氧化物,在充放电反应过程中,随着锂离子的嵌入\脱出,金属离子具有很大的化合价改变,因为生成了不同的相,导致正极材料的体积变化。
所以正极材料的性能除了和它本身的电化学性能,还与其微观结构相关。
纳米材料具有很高的比表面积和内部空隙,可以提高材料的锂离子容量。
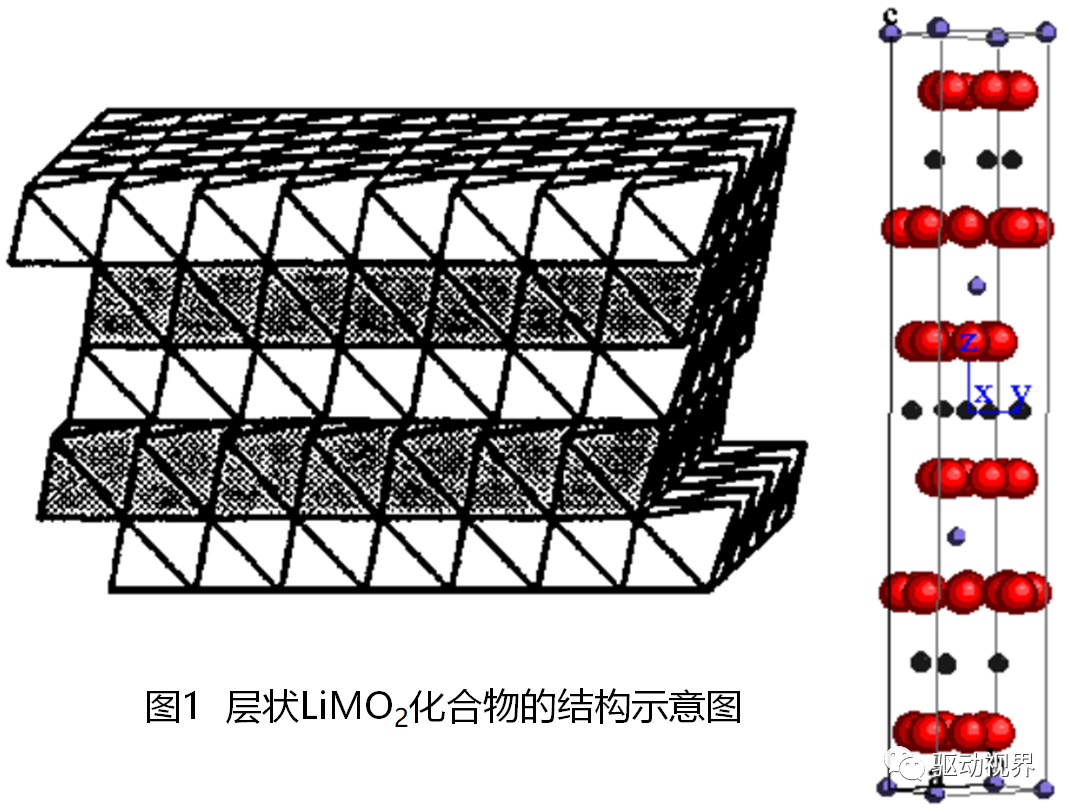
LiMO2层状结构材料
目前应用最多的是层状结构的LiCoO2
具有层状结构的LiCoO2,由于其合成工艺简单,电化学性质稳定等优势,所以率先进入市场,并在目前的锂离子二次电池市场中占据主导地位。
LiCoO2二维层状结构属于a-NaFeO2型,适合于锂离子嵌入和脱嵌。
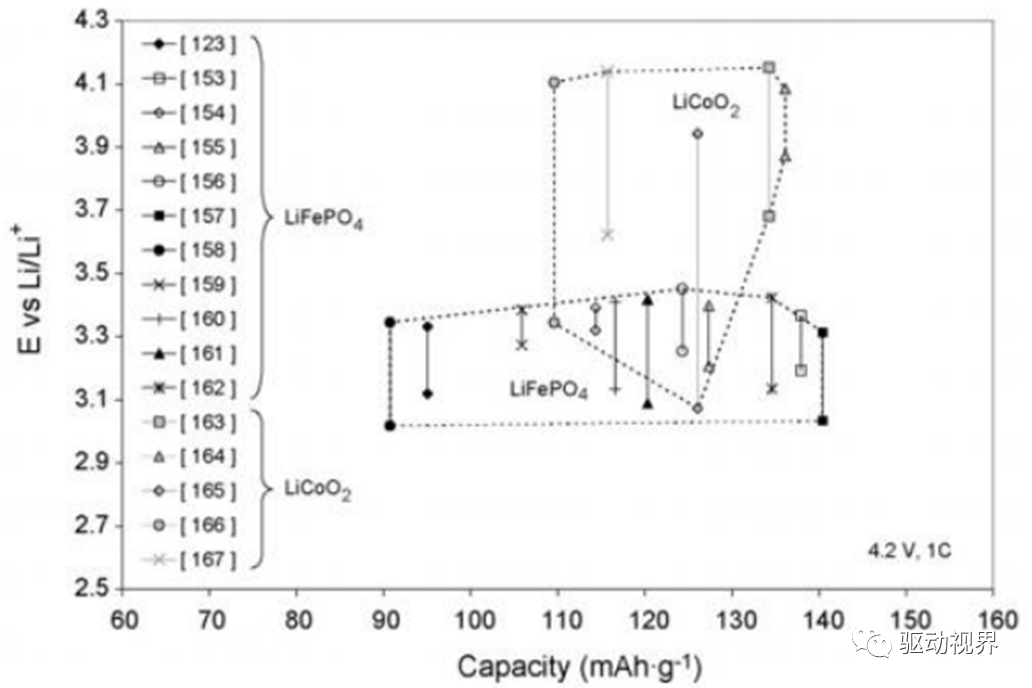
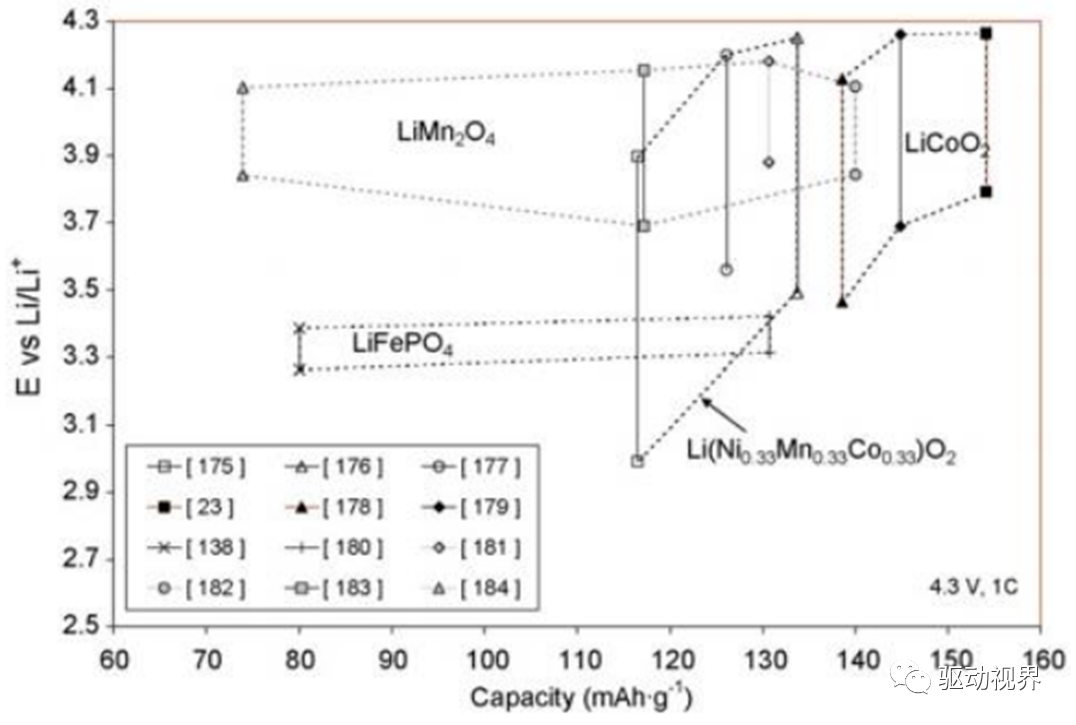
LiMPO4尖晶石结构材料
尖晶石结构的材料(包括LiFePO4、LiMnPO4、LiFePO4)具有八面体间隙,这样允许锂离子以三维网络形式而不是通过层面嵌入,同时这一类材料比LiCoO2的成本更低。
其缺陷在于循环性能和电压不如层状结构材料。
钒氧化物材料
金属钒是一种变价金属,同样可以用于锂离子电池正极材料。
包括正交晶系的V2O5和单斜晶系的LiV3O8。
但是和上述层状结构材料相比,电压较低(<3v)
三元复合材料
两种电极材料复合可以用来增强其性能,比如:向LiFePO4加入Li(Li0.17Mn0.58Ni0.25)O2和Li(Ni0.5Mn0.3Co0.2)O2,可以增加电池的循环性能。
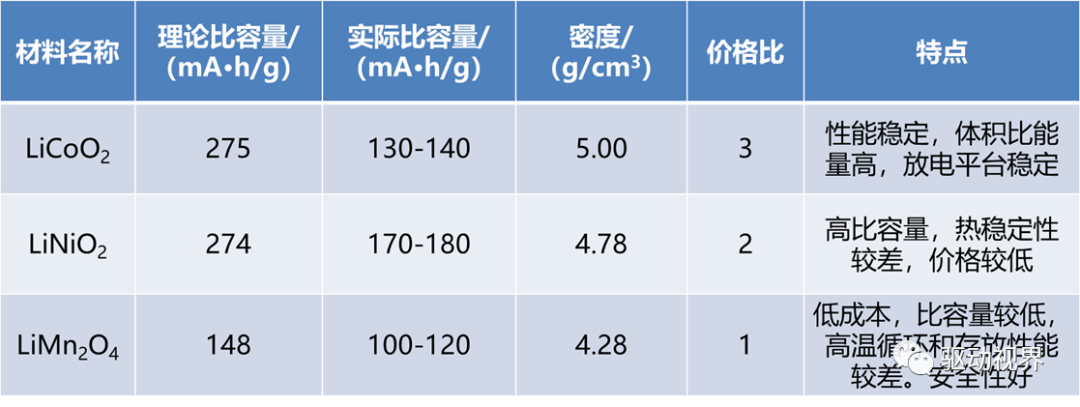
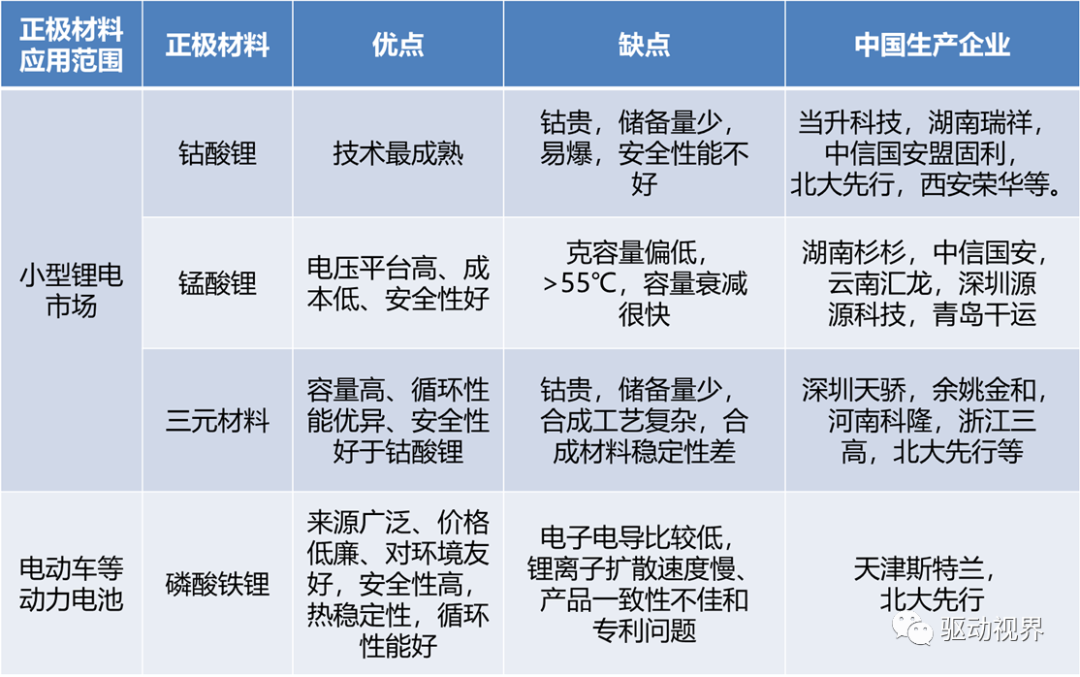
我国正极材料使用情况
电解质材料
根据锂离子电池所用电解质材料不同,锂离子电池可以分为液态锂离子电池(lithiumion battery, 简称为LIB)和聚合物锂离子电池(polymer lithium ion battery,简称为LIP)它们的主要区别在于正极或电解质的不同, 锂离子电池使用的是液体电解质, 而聚合物锂离子电池则以聚合物电解质来代替,这种聚合物可以是“干态”的,也可以是“胶态”的,目前大部分采用聚合物胶体电解质。
液体电解质材料要求
对有机电解液而言,要求:
1)离子电导率高
2)电化学稳定的电位范围宽:必须有0—5V 的电化学稳定窗口。
3) 热稳定好,使用温度范围宽。
4) 化学性能稳定,与电池内集电流体和活性物质不发生化学反应
5) 安全低毒,最好能生物降解。
对高电压下不分解的有机溶剂和电解质的研究是锂离子电池开发的关键。
由于水理论分解电位只有1.23V即使考虑氢或氧的过电位,以水为溶剂的电解液体系电池电压最高也只有2V 左右(如铅酸电池)锂离子电池电压高达3-4V。
传统水溶液体系显然已经不再适应电池需要。
液体电解质材料
电解液目前主要是非水液态电解液,一般由多组分混合溶剂、锂盐溶质(主要为六氟磷酸锂:LiPF6)以及必要的添加剂按照一定的配方比混合而成。
主要优点:电化学稳定性较高;在非水有机溶剂中溶解度高;离子电解率良好;在首次充放电时,可以在电极上,尤其是负极上形成一层SEI膜,从而阻止溶剂分子共插对电极的破坏,提高了电池的循环效率和可逆容量。
主要缺点:热稳定性较差,且易水解,需进行提纯以改善。
但由于目前尚未研发出更好的替代品,所以仍然会是最主流的锂盐溶质。
聚合物电解质材料
(1)固体聚合物电解质锂离子电池。电解质为聚合物与盐的混合物,这种电池在常温下的离子电导率低,适于高温使用。
(2)凝胶聚合物电解质锂离子电池。即在固体聚合物电解质中加入增塑剂等添加剂,从而提高离子电导率,使电池可在常温下使用。
(3)聚合物正极材料的锂离子电池。采用导电聚合物作为正极材料,其比能量是现有锂离子电池的3倍,是最新一代的锂离子电池。
隔膜材料
锂离子电池的隔膜材料是一种多孔的薄膜,用于阻隔正负极防止电池内部短路,又可以让离子流快速通过,完成充放电的过程。
目前电解液仍是以液态的极性有机溶剂为主,腐蚀性强,电导率相对水溶液低,这就要求隔膜必须耐腐蚀,同时比表面积大、孔隙率高。
二次化学电池包括燃料电池、镍氢电池、锂离子电池,是一种储能材料。
研究电池的目的无非在于以下几点:
1. 提高电池容量
2. 改善电池稳定性和适用能力(更广的温度范围,更大电流、电压输出)
3. 增加电池寿命,改善电池循环性能和安全性
4. 降低电池适用成本,减少污染
上述内容提到的质子交换膜电池(氢燃料电池、直接酒精燃料电池)、镍氢电池、锂离子电池(聚合物锂离子电池)发展目标都是更高容量和更高效率的动力电池,以求应用于电动汽车等大型设备和智能电网等方面。
三类电池比较
镍氢电池PK锂离子电池——有害指数比较
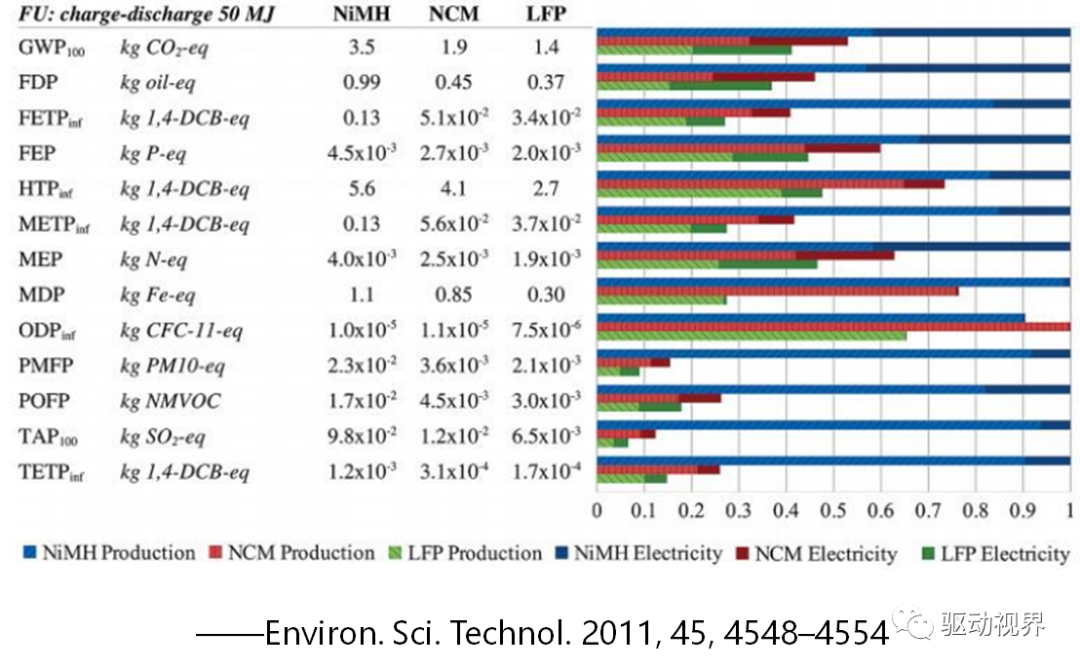
Fuel cells and batteries:Competition or separate paths?
——D. Ilic et al. / Journal of PowerSources 155 (2006) 72–76
目前锂离子电池的制造成本、工作电压、容量等性能都高于酒精直接燃料电池,可见燃料电池的实际应用还需要约7-12年的时间来发展,并且其应用也可能局限于没有电源的区域。
Li-ion batteries and portable powersource prospects for
the next 5–10 years
——M. Broussely, G. Archdale /Journal of Power Sources 136 (2004) 386–394
未来5-10年内可能没有新的电池出现,酒精直接燃料电池的较低容量密度也无法战胜锂离子电池,所以目前锂离子电池还是动力电池的希望。
声明:来源于驱动视界




