NiTi心血管支架的疲劳断裂性能分析
摘 要:
目的 对NiTi合金心血管支架进行疲劳寿命的预测研究。方法 采用疲劳断裂的有限元分析方法, 建立了三维空间NiTi心血管支架结构的模型, 并分析了在生理脉动循环载荷作用下的心血管支架结构。结果 有限元分析发现支架结构结点附近区域的正应力大、疲劳寿命低、损伤大;同时, 支架结构的疲劳寿命预测发现, 用结构表面进行氮化、喷丸硬化等方法处理的支架疲劳寿命较高。相关的实验结果显示疲劳裂纹或断裂总是发生在支架结点附近区域。结论 生理载荷下的模拟结果与相关的实验结果相吻合, 最终为心血管支架结构的安全性指导和设计提供了理论依据。
关键词:NiTi心血管支架;有限元分析;疲劳断裂;正应力;数值模拟;应力分布;
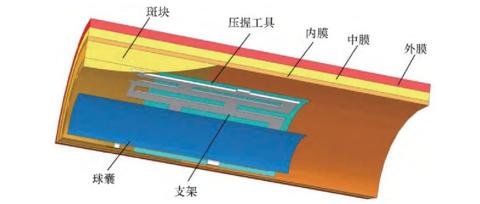
NiTi形状记忆合金具有良好的形状记忆效应和超弹性特性, 以及较长的疲劳寿命、优异的抗腐蚀性、抗打结性、较好的生物相容性等, 在医学、航天航空、核电等领域中得到了广泛的应用[1]。NiTi合金制成各类腔内支架就是一个成功的例证[2,3,4]。许多资料表明, 将Ni Ti引入心血管等腔内是最具有发展前景的医学领域之一。这种合金支架不但是一项全新的、应用最早最广的医用技术装置, 而且也是一种治疗各种管腔狭窄的重要技术手段 (见图1) 。从其工作机理上看, 该类医疗装置均是自膨胀型的器械, 通常利用NiTi合金的SME或PE功能研制而成, 因为Ni Ti合金的相变点可以在体温附近进行调节, 这是其他种类的形状记忆合金所不具备的性能。然而, 使用中的NiTi支架通常会承受生理脉动循环载荷或器官壁的径向压力的作用, 这些载荷常导致支架结构发生记忆性能衰减甚至疲劳断裂失效, 再加上支架结构形状的复杂性, 以及研究有关NiTi支架结构的文献很少[5,6,7,8,9,10,11], 所以在一定的工作条件下, 研究支架的疲劳断裂失效机理就显得尤为重要。

迄今为止, 关于对形状记忆合金支架的研究已做了一定的工作。Takashima等[5]通过试验和有限元方法对两类支架的结构进行了分析, 分别给出了支架和管腔内壁接触应力的分布情况, 最后得到了支架结构的尺寸和其抵抗外力大小的关系。为了得到支架结构的一些机械属性, Etavea等[12]利用数值的方法研究了两种支架模型, 专门分析了支架膨胀时的外推力、支架的回复力、支架的柔韧性以及抵抗外压力的能力等7个重要的属性。Gay等[6]采用复杂的流固耦合方法对支架进行了分析, 得到了支架的一些机械行为, 如支架膨胀机制、结构上的应力分布以及支架周围液体流速的分布情况等。
将NiTi支架介入各种管腔的治疗技术是智能材料的一项高精端关键技术, 由于这类支架结构的性能高低对病人的治疗起着关键性的作用, 所以对其结构设计提出了较为严格的要求。比如, 为了使支架的疲劳寿命达到一定的指标, 制造商一般通过做径向脉动实验来确定支架是否达到这一指标要求[13,14]。为此, 需要对心血管支架结构进行一些必要的基础研究和分析。本文利用有限元数值分析方法, 在径向压力或生理脉动循环载荷的作用下, 对一较完整的NiTi合金支架结构进行疲劳断裂/寿命的预测研究分析。
1 材料参数及有限元模型
1.1 材料参数
采用Auricchio本构模型对NiTi心血管支架进行有限元分析[1]。在数值模拟中, 支架所采用的材料为Ni-50.9at.%Ti合金材料, 其材料机械模型参数见表1。疲劳分析是根据材料的S-N曲线和Palrngren-Miner累积损伤理论进行全寿命预测。分析中以支架的应力为基础, 采用最大主应力分析, 应力集中系数Kf为4。由于NiTi合金为延性材料, 所以选择Gerber方法进行平均应力修正, 材料的S-N曲线见图2, 其他的材料参数详见文献[2, 15]。


根据构件的S-N曲线进行的数值分析, 只能代表标准光滑试样的疲劳性能。而实际构件的形状和表面情况是各式各样的, 与标准试样有很大差别。同时, 又因为疲劳裂纹源一般萌生于构件的自由表面, 因此, 构件的表面性能和加工历史对其疲劳性能有着决定性的作用。另外, 在所用的专业疲劳分析MSC.Fatigue软件中, 有多达20组不同的表面处理方法可供选择[17]。所以, 文中讨论了构件不同表面处理方法 (如表面氮化、喷丸等) 对疲劳性能的影响。
1.2 有限元模型
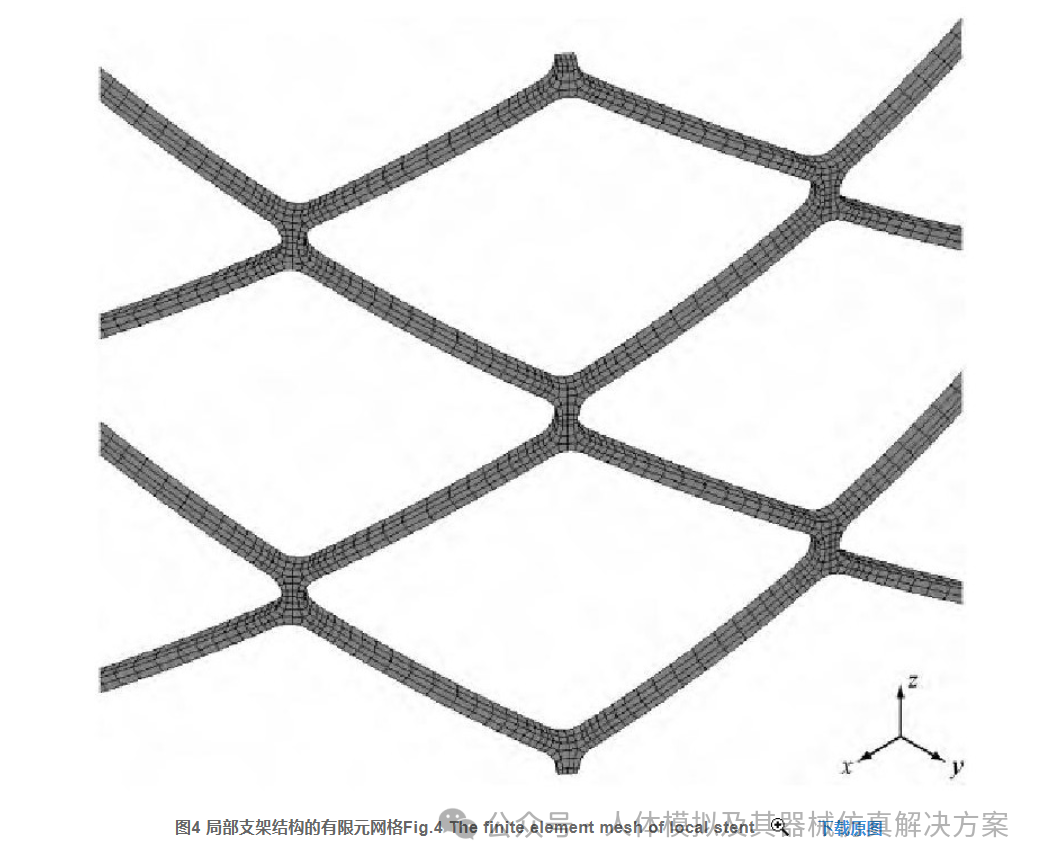
有限元分析所采用的模型为一圆柱形网状的支架结构, 这种结构模型是通过专门的CAD软件Solidwork建模而成 (见图3) 。此模型是从原始心血管支架结构[15,18,19]中抽取的有代表性的一部分结构, 具体的结构尺寸为高度3.0 mm, 内半径5.5 mm, 外半径5.65 mm, 厚度0.15 mm, 单筋宽0.1 mm, 小倒角半径0.05 mm, 大倒角半径0.565 mm。对有限元支架模型全部采用八节点六面体单元 (C3D8) 网格离散, 单元数总共有9 360个 (见图4) 。

由于支架结构模型在外载下, 发生自由膨胀/压缩变形, 所以根据载荷和结构的对称性, 简化的边界条件为:在支架结构上, 约束所有对称 (xy、xz、yz) 平面上的节点。同时, 为了模拟心血管支架在径向压力或生理脉动循环 (如心脏收缩/舒张) 的载荷环境, 首先在支架内壁施加最大压力 (1.0 MPa) , 利用MSC.Marc商用软件进行静态应力/变计算分析;然后再利用MSC.Fatigue商用软件对其进行等幅脉动载荷的疲劳寿命分析 (所用的载荷谱为正弦曲线, 频率60 Hz) , 具体的步骤见图5。

2 结果与分析
图6给出了支架结构在最大载荷下的von Mises应力分布情况。由图6可见, 支架结构上, 在结点与结点之间大约1/3的区域内应力较大, 而结点间中间部分的应力较小, 最大应力发生在每个大倒角/槽口附近。图7曲线从另一角度说明, 支架结点附近的应力最大 (其值为528.4 MPa) , 两相邻结点中间的位置应力最小 (其值为10.2 MPa) , 并且约有1/3以上区域应力大于400 MPa, 这种应力分布和图6中的表述完全一致。从应力角度看, 结果表明在每个倒角附近很容易发生裂纹/断裂。特别是在循环载荷作用下, 这些部位更容易发生疲劳断裂失效。
图8给出了支架结构, 在最大载荷下的正应力分布情况。由图8的数据可以得出, 在结构的每个结点/倒角附近的正应力较大, 然而最大正应力值发生在结构的小倒角/槽口处, 其余部位处的较小。这说明在各结点附近, 倒角/槽口处较大的正应力是导致支架断裂失效的另外一个主要原因。
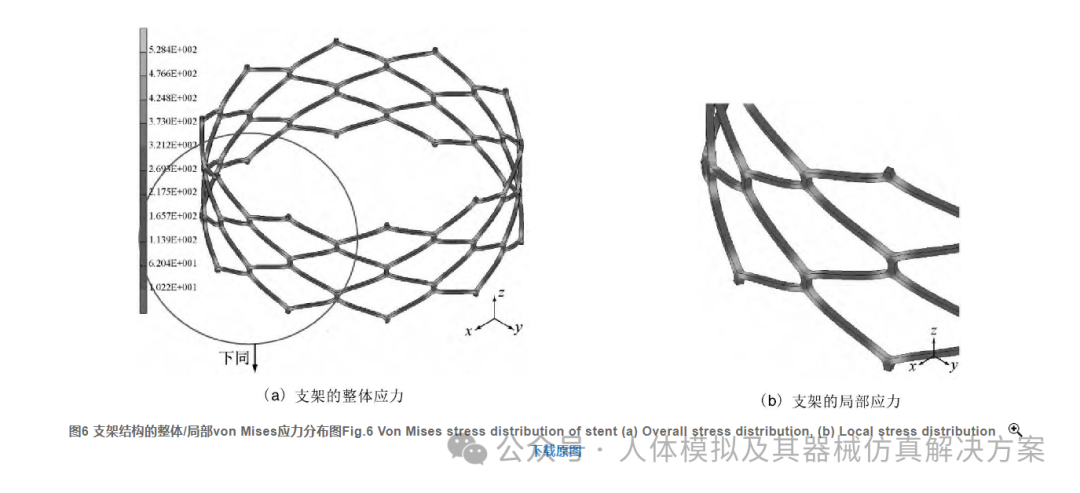



图9给出了支架结构在最大载荷下的马氏体体积分数分布的情况。由图9的数据可以发现, 在各倒角附近, 即在较大的应力区域 (见图6) , 支架结构上有较多的马氏体转变, 而其余部分的马氏体体积分数很小。这说明, 在支架结构上, 马氏体的转变和应力分布有直接的关系, 即较大的应力位置将是引起马氏体的转变的区域。
图10给出了支架结构的疲劳对数寿命分布情况。由图10的计算结果可以发现, 支架结构倒角附近的疲劳寿命较低, 最小的对数寿命 (约为5.5年) 位于倒角表面附近的区域, 其余位置的寿命较大。其中, 疲劳寿命小的部位大多位于支架结构的倒角附近, 这些区域是支架结构上出现较大正应力的位置 (见图8) , 这说明较高的正应力在同一位置的反复发生, 是造成疲劳寿命低的直接起源。所以支架结构的疲劳破环首先是从其倒角表面附近开始发生, 这一点已被本文的合作者 (德国Ruhr大学的Eggeler教授课题组) 通过实验证实[21]。此实验进一步表明, 有限元模拟分析结果和试验完全相符, 即在支架结点间大约1/3的区域内 (较大正应力的区域) 易于发生疲劳断裂失效。
表2给出了结构不同表面加工和热处理对寿命的影响比较。由表2可以得出, 不同的表面加工和热处理, 对结构疲劳寿命的影响则不同, 在允许的条件下, 尽可能对表面采取氮化、喷丸硬化等方法进行处理, 这样可以延长结构的使用期限/寿命。

较大的正应力在同一位置的反复发生, 是造成局部疲劳损伤产生的直接原因;同时也说明这些局部不可逆的损伤积累, 才是导致局部疲劳寿命低的起源。
3 结论
NiTi支架介入人体管腔内的技术是治疗各种管腔病变的重要手段。因此, 为了把NiTi支架安全地应用到临床中去, 急需对心血管支架结构进行一些必要的基础研究和分析。本文对某一支架结构进行了有代表性的力学性能分析, 通过结果研究最后取得如下结论:
(1) 支架结构上, 结点间约1/3的区域内 (正) 应力较大, 而两结点中间部分的应力较小, 最大应力发生在各倒角附近。这说明, 在各结点附近, 大小倒角处较大的 (正) 应力是导致支架失效的一个主要原因。
(2) 支架结构的正应力分布状态是影响结构疲劳寿命的直接原因, 即, 结点处局部的较大正应力分布是导致结构疲劳寿命低、损伤大、结构断裂的另一个主要原因。
(3) 支架结构结点附近的区域疲劳寿命较低、损伤较大是导致结构局部容易发生疲劳失效的又一个主要原因, 所以支架结构的疲劳断裂破环首先是从其结点附近开始发生。
(4) 支架结构的疲劳寿命与其不同表面加工和热处理也有很大的关系。对其表面进行氮化、喷丸硬化等方法处理后, 可以大大地延长支架结构的使用期限/寿命。
参考文献:[1]智友海,史向平.NiTi心血管支架的疲劳断裂性能分析[J].医用生物力学,2011,26(01):1-6.DOI:10.16156/j.1004-7220.2011.01.007.
免责说明:文章仅供交流学习,版权归原作者所有。如有涉及版权,请联系删除!